题目内容
下列说法正确的是( )
| A、常温下,醋酸钠与醋酸的混合溶液pH=7,C(Na+)>c(CH3COO-) |
| B、0.1mol/L Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| C、将pH=6的H2SO4稀释1000倍后,c(H+)=2c(SO42-) |
| D、0.1mol/L NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A.溶液的PH=7,则c(OH-)=c(H+),再结合电荷守恒判断;
B.任何电解质溶液中都存在物料守恒和电荷守恒,根据物料守恒和电荷守恒判断;
C.pH=6的硫酸稀释1000倍后溶液接近中性,氢离子浓度为中性溶液中氢离子浓度,根据物质的量不变计算硫酸根离子浓度;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断.
B.任何电解质溶液中都存在物料守恒和电荷守恒,根据物料守恒和电荷守恒判断;
C.pH=6的硫酸稀释1000倍后溶液接近中性,氢离子浓度为中性溶液中氢离子浓度,根据物质的量不变计算硫酸根离子浓度;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断.
解答:
解:A.溶液的pH=7,则c(OH-)=c(H+),根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(Na+)=c(CH3COO-),故A错误;
B.任何电解质溶液中都存在物料守恒和电荷守恒,根据物料守恒c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),根据电荷守恒c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),所以得c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),故B错误;
C.pH=6的硫酸稀释1000倍后溶液接近中性,氢离子浓度为中性溶液中氢离子浓度10-7 mol/L,根据物质的量不变得硫酸根离子浓度为10-9 mol/L,所以c(H+)=100c(SO42-),故C错误;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),故D正确;
故选D.
B.任何电解质溶液中都存在物料守恒和电荷守恒,根据物料守恒c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),根据电荷守恒c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),所以得c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),故B错误;
C.pH=6的硫酸稀释1000倍后溶液接近中性,氢离子浓度为中性溶液中氢离子浓度10-7 mol/L,根据物质的量不变得硫酸根离子浓度为10-9 mol/L,所以c(H+)=100c(SO42-),故C错误;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),故D正确;
故选D.
点评:本题考查了离子浓度大小的判断,根据溶液中的溶质及其性质来分析解答,结合电荷守恒和物料守恒分析,易错选项是C,注意:当溶液稀释接近中性时,不能根据稀释倍数计算溶液中氢离子浓度,为易错点.

练习册系列答案
相关题目
在下列下列说法正确的是( )
| A、加入铝粉生成H2的溶液中,K+、Cu2+、SO42-、ClO-能大量共存 |
| B、在c(OH-)=10-2 mol?L-1的溶液中,NO3-、Ba2+、Cl-、Br-能大量共存 |
| C、0.1 mol/L Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) |
| D、0.1 mol/L Na2CO3溶液中:2c(Na+)=c(H2CO3)+c(CO32-)+c(HCO3-) |
常温下,下列各溶液中微粒的物质的量浓度关系正确的是( )
| A、将pH=6的H2SO4 稀释1000倍后,c(H+)=2c(SO42-) |
| B、0.1mol?L-1的Na2CO3溶液中:c(OH- )=c(HCO3- )+c(H+)+c(H2CO3) |
| C、浓度均为0.1mol?L-1的NaClO溶液和CH3COONa溶液中,c(ClO-)<c(CH3COO-) |
| D、浓度分别为0.1mol?L-1和0.01mol?L-1的CH3COOH溶液中:c(CH3COO-)前者是后者的10倍 |
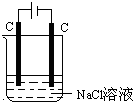 图为电解饱和食盐水示意图,下列说法正确的是( )
图为电解饱和食盐水示意图,下列说法正确的是( )| A、阳上析出氢气 |
| B、阴极上发生氧化反应 |
| C、电解时,溶液的pH增大 |
| D、与电源正极相连的是电解池的阴极 |
设阿伏加德罗常数为NA.则下列说法正确的是( )
A、常温常压下,6 g
| ||
| B、标准状况下,0.3 mol二氧化硫中含有氧原子数为0.3NA | ||
| C、常温下,2.7 g铝与足量的盐酸反应,失去的电子数为0.3NA | ||
| D、常温下,1 L 0.1 mol/L MgCl2溶液中含Mg2+数为0.2NA |
 利用Cu+2FeCl3=CuCl2+2FeCl2反应,设计一个原电池.
利用Cu+2FeCl3=CuCl2+2FeCl2反应,设计一个原电池.