题目内容
硝酸是一种强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而有变化,从总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产物主要为NO2,稀硝酸的还原产物主要为NO.实验室中,常用Cu与浓HNO3反应制取NO2,用Cu与稀HNO3反应制取NO.
(1)请写出实验室中用Cu与浓HNO3反应制取NO2的化学方程式: .
(2)该反应中发生氧化反应的物质是 ,1mol氧化剂 (填“得到”或“失去”) mol电子.
(3)48.0gCu与适量的浓HNO3反应,铜全部作用后,共收集到22.4L气体(标准状况下),反应中消耗HNO3的物质的量可能是 .
A.1.5mol B.2.0mol C.2.5mol D.3.0mol
(4)实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等.请将3种物质:FeSO4、Fe(NO3)3和Fe2(SO4)3分别填入对应的横线上,组成一个未配平的化学方程式.
HNO3+ +N2O↑+H2O,
写出配平后的离子方程式为 .
(5)硝酸的还原产物NO、NO2、N2O等对环境均有副作用,为了可持续发展,当今社会提出的一个新概念--“绿色化学”,它要求从经济、环保和技术上设计可行的化学反应,则下列由单质铜制取硝酸铜的方法可行且符合“绿色化学”的是
A.Cu
Cu(NO3)2
B.Cu
CuO
Cu(NO3)2
C.Cu
CuO
Cu(OH)2
Cu(NO3)2
D.Cu
CuSO4
Cu(NO3)2.
(1)请写出实验室中用Cu与浓HNO3反应制取NO2的化学方程式:
(2)该反应中发生氧化反应的物质是
(3)48.0gCu与适量的浓HNO3反应,铜全部作用后,共收集到22.4L气体(标准状况下),反应中消耗HNO3的物质的量可能是
A.1.5mol B.2.0mol C.2.5mol D.3.0mol
(4)实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等.请将3种物质:FeSO4、Fe(NO3)3和Fe2(SO4)3分别填入对应的横线上,组成一个未配平的化学方程式.
HNO3+
写出配平后的离子方程式为
(5)硝酸的还原产物NO、NO2、N2O等对环境均有副作用,为了可持续发展,当今社会提出的一个新概念--“绿色化学”,它要求从经济、环保和技术上设计可行的化学反应,则下列由单质铜制取硝酸铜的方法可行且符合“绿色化学”的是
A.Cu
| HNO3 |
B.Cu
| O2 |
| HNO3 |
C.Cu
| O2 |
| H2O |
| HNO3 |
D.Cu
| H2SO4 |
| Ba(NO3)2 |
考点:硝酸的化学性质,氧化还原反应,氧化还原反应方程式的配平,制备实验方案的设计
专题:元素及其化合物
分析:(1)铜与浓硝酸反应生成硝酸铜、二氧化氮与水;
(2)所含元素化合价升高的物质发生氧化反应;氧化剂获得电子,发生还原反应,结合N元素化合价变化计算转移电子;
(3)铜和硝酸反应,随着浓度的减少,硝酸的还原产物的价态越低,铜和浓硝酸反应生成NO2,而与稀硝酸反应时则生成NO,故生成的气体可能只有NO2或NO2和NO混合物,由于每个气体分子都含有1个N原子,故气体的物质的量等于被还原的硝酸的物质的量,根据生成硝酸铜的物质的量可知表现酸性的硝酸的物质的量,这两部分硝酸的质量即为消耗的硝酸的质量;
(4)所给的物质组合中,HNO3中氮元素化合价位于最高价,具有氧化性,对应还原产物为NO2,能将还原性的FeSO4氧化为Fe2(SO4)3,根据氢原子守恒,水在生成物中,配平完成方程式;
元素处于最高价只有氧化性,元素居于低价有还原性,根据所给物质的化合价情况及电子转移守恒、原子守恒来分析解答;
(5)制备硝酸铜,要符合绿色化学的要求方案,应杜绝生成污染性气体,且实验步骤少,消耗原料较少,以此解答该题.
(2)所含元素化合价升高的物质发生氧化反应;氧化剂获得电子,发生还原反应,结合N元素化合价变化计算转移电子;
(3)铜和硝酸反应,随着浓度的减少,硝酸的还原产物的价态越低,铜和浓硝酸反应生成NO2,而与稀硝酸反应时则生成NO,故生成的气体可能只有NO2或NO2和NO混合物,由于每个气体分子都含有1个N原子,故气体的物质的量等于被还原的硝酸的物质的量,根据生成硝酸铜的物质的量可知表现酸性的硝酸的物质的量,这两部分硝酸的质量即为消耗的硝酸的质量;
(4)所给的物质组合中,HNO3中氮元素化合价位于最高价,具有氧化性,对应还原产物为NO2,能将还原性的FeSO4氧化为Fe2(SO4)3,根据氢原子守恒,水在生成物中,配平完成方程式;
元素处于最高价只有氧化性,元素居于低价有还原性,根据所给物质的化合价情况及电子转移守恒、原子守恒来分析解答;
(5)制备硝酸铜,要符合绿色化学的要求方案,应杜绝生成污染性气体,且实验步骤少,消耗原料较少,以此解答该题.
解答:
解:(1)铜与浓硝酸反应生成硝酸铜、二氧化氮与水,反应方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
(2)反应中Cu元素化合价升高,发生氧化反应,硝酸是氧化剂,获得电子,其化合价由+5降低为+4,故1mol硝酸完全其氧化剂作用,转移电子为1mol,
故答案为:Cu;得到;1;
(3)铜和硝酸反应,随着浓度的减少,硝酸的还原产物的价态越低,铜和浓硝酸反应生成NO2,而与稀硝酸反应时则生成NO,故生成的气体可能只有NO2或NO2和NO混合物,由于每个气体分子都含有1个N原子,故气体的物质的量等于被还原的硝酸的物质的量,
n(气体)=
=1mol,即被还原的硝酸的物质的量为1mol,
n(Cu)=
=0.75mol,则生成n[Cu(NO3)2]=0.75mol,可知表现酸性的硝酸的物质的量为0.75mol×2=1.5mol,
则参加反应的硝酸的物质的量为:1.0mol+1.5mol=2.5mol,
故答案为:C;
(4)所给的物质组合中,HNO3中氮元素化合价位于最高价,具有氧化性,对应还原产物为NO2,能将还原性的FeSO4氧化为Fe2(SO4)3,根据氢原子守恒,水在生成物中,配平后发生的反应为:30HNO3+24FeSO4=8Fe(NO3)3+8Fe2(SO4)3+3N2O+15H2O,
故答案为:FeSO4;→Fe(NO3)3+Fe2(SO4)3;8Fe2++2NO3-+10H+=8Fe3++N2O↑+5H2O;
(5)A.会生成氮的氧化物,不符合绿色化学的要求;
B.生成氧化铜与硝酸反应生成硝酸铜和水,绿色环保,符合绿色化学的要求;
C.CuO不能与水反应生成氢氧化铜,方案不可能,
D.会生成二氧化硫,不符合绿色化学的要求;
故选B.
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
(2)反应中Cu元素化合价升高,发生氧化反应,硝酸是氧化剂,获得电子,其化合价由+5降低为+4,故1mol硝酸完全其氧化剂作用,转移电子为1mol,
故答案为:Cu;得到;1;
(3)铜和硝酸反应,随着浓度的减少,硝酸的还原产物的价态越低,铜和浓硝酸反应生成NO2,而与稀硝酸反应时则生成NO,故生成的气体可能只有NO2或NO2和NO混合物,由于每个气体分子都含有1个N原子,故气体的物质的量等于被还原的硝酸的物质的量,
n(气体)=
| 22.4L |
| 22.4L/mol |
n(Cu)=
| 48g |
| 64g/mol |
则参加反应的硝酸的物质的量为:1.0mol+1.5mol=2.5mol,
故答案为:C;
(4)所给的物质组合中,HNO3中氮元素化合价位于最高价,具有氧化性,对应还原产物为NO2,能将还原性的FeSO4氧化为Fe2(SO4)3,根据氢原子守恒,水在生成物中,配平后发生的反应为:30HNO3+24FeSO4=8Fe(NO3)3+8Fe2(SO4)3+3N2O+15H2O,
故答案为:FeSO4;→Fe(NO3)3+Fe2(SO4)3;8Fe2++2NO3-+10H+=8Fe3++N2O↑+5H2O;
(5)A.会生成氮的氧化物,不符合绿色化学的要求;
B.生成氧化铜与硝酸反应生成硝酸铜和水,绿色环保,符合绿色化学的要求;
C.CuO不能与水反应生成氢氧化铜,方案不可能,
D.会生成二氧化硫,不符合绿色化学的要求;
故选B.
点评:本题考查氧化还原反应基本概念、计算与配平以及对实验方案的评价等,综合考查学生分析解决问题能力,(3)中注意根据守恒思想进行计算,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列离子方程式正确的是( )
| A、铁跟盐酸反应:2Fe+6H+═2Fe3++3H2↑ |
| B、氯气与水反应:Cl2+H2O═2H++Cl+ClO- |
| C、硫酸与氢氧化钡溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| D、金属钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ |
下列说法正确的是( )
| A、常温下,醋酸钠与醋酸的混合溶液pH=7,C(Na+)>c(CH3COO-) |
| B、0.1mol/L Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| C、将pH=6的H2SO4稀释1000倍后,c(H+)=2c(SO42-) |
| D、0.1mol/L NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) |
 某条件下在密闭容器中发生反应X2+3Y2?2Z2,右图是反应过程中,反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
某条件下在密闭容器中发生反应X2+3Y2?2Z2,右图是反应过程中,反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )| A、0~t1时,X2、Y2、Z2的物质的量浓度由于反应进行而减小 |
| B、t2~t3时,反应体系中Y2的浓度没有变化 |
| C、到t3以后,反应已达限度,不管如何改变条件,反应不再进行 |
| D、从关系曲线可知,反应开始时体系中只有X2和Y2 |
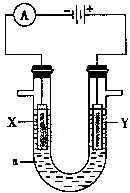 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.
电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.
 的合成路线流程图(无机试剂任用)
的合成路线流程图(无机试剂任用)