题目内容
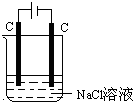 图为电解饱和食盐水示意图,下列说法正确的是( )
图为电解饱和食盐水示意图,下列说法正确的是( )| A、阳上析出氢气 |
| B、阴极上发生氧化反应 |
| C、电解时,溶液的pH增大 |
| D、与电源正极相连的是电解池的阴极 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:电解饱和食盐时阳极阴离子Cl-、OH-放电,Cl-的放电能力强于OH-,阳极发生的方程式为:2Cl--2e-═Cl2↑,阴极:2H++2e-═H2↑,以此解答.
解答:
解:A.阳极发生氧化反应生成氯气,故A错误;
B.阴极发生还原反应生成氢气,故B错误;
C.电解方程式2NaCl+2H2O
2NaOH+Cl2↑+H2↑,可知生成氢氧化钠,则电解时,溶液的pH增大,故C正确;
D.与电源正极相连的是电解池的阳极,故D错误.
故选C.
B.阴极发生还原反应生成氢气,故B错误;
C.电解方程式2NaCl+2H2O
| ||
D.与电源正极相连的是电解池的阳极,故D错误.
故选C.
点评:该题是高考中的常见考点和题型,属于中等难度试题的考查,试题综合性强,主要是考查学生对原电池的电极反应、现象和电极反应式的书写等的掌握情况,侧重对学生基础知识的巩固和训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
 A、B两种酸溶液的pH都是2,各取1mL分别加水稀释成1000mL,其pH的变化如图所示,则下列判断正确的是( )
A、B两种酸溶液的pH都是2,各取1mL分别加水稀释成1000mL,其pH的变化如图所示,则下列判断正确的是( )| A、原酸溶液的浓度c(A)=c(B) |
| B、原酸溶液的浓度c(A)>c(B) |
| C、若a=5,则A为强酸,B为弱酸 |
| D、若2<a<5,则A、B都是弱酸,酸性A<B |
下列事实所对应的方程式不正确的是( )
| A、盛放氢氧化钠溶液的试剂瓶不能用玻璃塞:SiO2+2NaOH═Na2SiO3+H2O | ||||
B、高温下铁与水蒸气反应生成保护膜:2Fe+6H2O(g)
| ||||
| C、工业制取漂粉精:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O | ||||
| D、实验室制取氨气:2NH4Cl+Ca(OH)2═CaCl2+2NH3↑+2H2O |
下列各组离子在指定溶液中能大量共存的是( )
| A、无色溶液中:K+、Na+、MnO4-、SO42- |
| B、由水电离出的c(OH- )=1.0×10-13mol L-1的溶液中:Na+、Ba2+、Cl-、Br- |
| C、有较多Fe3+的溶液中:Na+、NH4+、HCO3-、SO42- |
| D、强酸性溶液中:K+、NH4+、I-、NO3- |
下列说法正确的是( )
| A、常温下,醋酸钠与醋酸的混合溶液pH=7,C(Na+)>c(CH3COO-) |
| B、0.1mol/L Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| C、将pH=6的H2SO4稀释1000倍后,c(H+)=2c(SO42-) |
| D、0.1mol/L NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) |
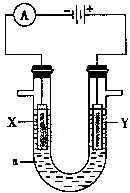 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.
电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.