题目内容
18.对处于化学平衡的体系,以化学平衡与化学反应速率的关系可知( )| A. | 化学反应速率变化时,化学平衡一定发生移动 | |
| B. | 正反应进行的程度大、正反应速率一定大 | |
| C. | 化学平衡发生移动时、化学反应速率一定变化 | |
| D. | 只有催化剂存在下,才会发生化学反应速率变化,而化学平衡不移动的情况 |
分析 化学平衡是否发生变化,取决于正逆反应速率的关系,如正逆反应速率相等,则平衡不移动,如正反应速率大于逆反应速率,平衡向正反应方向移动,否则向逆反应方向移动,催化剂改变反应速率不改变化学平衡.
解答 解:A.使催化剂化学反应速率都加快,但平衡不移动,故A错误;
B.减小生成物的浓度,平衡正向移动,正反应进行的程度增大,逆反应的速率减小,所以限度变大和速率不一定增大,故B错误;
C.平衡移动是外界条件改变,导致正逆反应速率不等,所以化学平衡发生移动时、化学反应速率一定变化,故C正确;
D.两边气体化学计量数相等的,改变压强平衡也不移动,所以不一定是催化剂,故D错误;
故选C.
点评 本题考查化学平衡与反应速率的关系,为高频考点,侧重于基本概念、理论知识的考查,题目难度不大,注意反应是否处于平衡状态,取决于正逆反应速率的大小关系.

练习册系列答案
相关题目
5.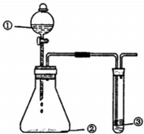 用如图所示装置进行下列实验,有关分析一定不正确的是
用如图所示装置进行下列实验,有关分析一定不正确的是
( )
 用如图所示装置进行下列实验,有关分析一定不正确的是
用如图所示装置进行下列实验,有关分析一定不正确的是( )
| 选項 | ① | ② | ③ | 预期现象或结论 |
| A | 稀H2SO4 | Na2SO3 | 澄清石灰水 | 滴入少量稀H2SO4时③中立即出现浑浊 |
| B | H2O2溶液 | FeCl3 | FeCl2溶液 | FeCl3作催化剂 |
| C | 盐酸 | KMnO4 | 淀粉KI溶液 | 氧化性:KMnO4>Cl2>I2 |
| D | 浓 HNO3 | Cu粉 | 石蕊溶液 | ③中可能先变后褪色 |
| A. | A | B. | B | C. | C | D. | D |
6.铁及其化合物在日常生活中应用广泛.已知Fe(NO3)3•9H2O易溶于水,微溶于硝酸,主要用作催化剂和媒染剂.工业上用细铁屑(含有少量杂质Cu)与稀硝酸反应制备,主要流程如下:
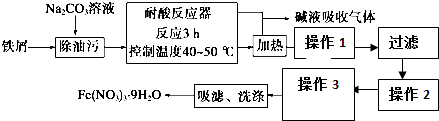
(1)Na2CO3溶液可以除油污,原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-
(2)操作1加入烧碱溶液,调节pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=2.6×10-9mol/L,能否视为Fe3+已经沉淀完全?是(是、否).
(3)操作2是在滤渣中加入足量的硝酸,硝酸足量的目的将Fe(OH)3完全溶解、抑制Fe3+水解
(4)操作3包含两步,分别为:蒸发浓缩、冷却结晶
(5)制得的Fe(NO3)3•9H2O用20% HNO3洗涤,目的:洗去表面杂质,减少因溶解而造成的损失.

| 物质 | Cu(OH)2 | Fe(OH)3 |
| Ksp | 2.2×10-20 | 2.6×10-39 |
(2)操作1加入烧碱溶液,调节pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=2.6×10-9mol/L,能否视为Fe3+已经沉淀完全?是(是、否).
(3)操作2是在滤渣中加入足量的硝酸,硝酸足量的目的将Fe(OH)3完全溶解、抑制Fe3+水解
(4)操作3包含两步,分别为:蒸发浓缩、冷却结晶
(5)制得的Fe(NO3)3•9H2O用20% HNO3洗涤,目的:洗去表面杂质,减少因溶解而造成的损失.
13.已知分解1g碳酸镁固体吸收1.366kJ,则它的热化学方程式是( )
| A. | MgCO3(s)═MgO(s)+CO2(g)△H=+1.366 kJ/mol | |
| B. | MgCO3(s)═MgO(s)+CO2(g)△H=-1.366 kJ/mol | |
| C. | MgCO3(s)═MgO(s)+CO2(g)△H=-114.7 kJ/mol | |
| D. | MgCO3(s)═MgO(s)+CO2(g)△H=+114.7 kJ/mol |
10.为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气.下列关于Na2O2的叙述正确的是( )
| A. | Na2O2中阴、阳离子的个数比为1:1 | |
| B. | Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等 | |
| C. | Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的物质的量相等 | |
| D. | Na2O2的漂白原理与活性炭的漂白原理相同 |
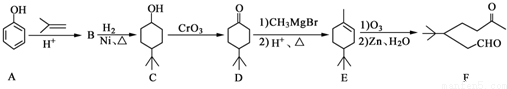
 .
. .同时满足下列条件的B的同分异构体(不包括B)共有11种:能与FeCl3溶液显紫色,苯环上只有两个取代基.
.同时满足下列条件的B的同分异构体(不包括B)共有11种:能与FeCl3溶液显紫色,苯环上只有两个取代基. (任写一种).
(任写一种).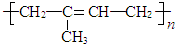 .
.