题目内容
9.下列说法或有关化学用语的表达正确的是( )| A. | 在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 | |
| B. | 基态Fe原子的外围电子排布图为 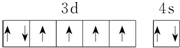 | |
| C. | 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 | |
| D. | 根据原子核外电子排布的特点,在Fe元素周期表中位于ds区 |
分析 A.同一层即同一能级中的p轨道电子的能量一定比s轨道电子能量高,但外层s轨道电子能量则比内层p轨道电子能量高;
B.基态铁原子外围电子排布式为3d64s2,根据洪特规则分析;
C.N原子的2p轨道处于半满,第一电离能大于氧原子;
D.Fe的外围电子排布式为3d64S2,位于元素周期表的d区.
解答 解:A.同一层即同一能级中的p轨道电子的能量一定比s轨道电子能量高,但外层s轨道电子能量则比内层p轨道电子能量高,故A错误;
B.基态铁原子外围电子排布式为3d64s2,根据洪特规则电子总是优先单独占据一个轨道,而且自旋状态相同,则外围电子排布图为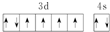 ,故B正确;
,故B正确;
C.N原子的2p轨道处于半满,第一电离能大于氧原子,故C错误;
D.Fe的外围电子排布式为3d64S2,位于元素周期表的d区,故D错误;
故选B.
点评 本题考查原子核外电子排布规律及排布式和排布图的书写,题目难度不大,本题注意原子核外电子的排布和运动特点.

练习册系列答案
相关题目
19.下列实验中均需要的仪器是( )
①蒸发 ②PH试纸的使用 ③过滤.
①蒸发 ②PH试纸的使用 ③过滤.
| A. | 试管 | B. | 胶头滴管 | C. | 玻璃棒 | D. | 漏斗 |
17.常温下,某溶液中含有两种溶质NaCl和H2SO4,它们的物质的量之比为5:2,用石墨作电极电解该混合溶液时,根据电解产物,可分为三个阶段,下列叙述不正确的是( )
| A. | 溶液pH不断增大,最后为7 | B. | 阳极先析出Cl2,后析出O2 | ||
| C. | 阴极始终只析出H2 | D. | 电解最后阶段为电解水 |
14.常温下向下列溶液中通入足量CO2,溶液中一直没有明显变化的是( )
| A. | 饱和Na2CO3溶液 | B. | NaOH稀溶液 | C. | 饱和Ca(OH)2溶液 | D. | CaCl2溶液 |
1.标准状况下,11.85克金属镁放入足量的盐酸溶液中,生成11.2L氢气.则金属镁中所含的杂质是( )
| A. | Al | B. | Na | C. | Zn | D. | Fe |
19.下列化学用语或模型表达正确的是( )
| A. | 乙醇的球棍模型为: | B. | 次氯酸的结构式为:H一C1一O | ||
| C. | 淀粉的结构简式为:[C6H12O6]n | D. | 乙烯的电子式为: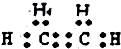 |
 .
.