题目内容
16.下列有关蛋白质的叙述不正确的是( )①向蛋白质溶液里加浓(NH4)2SO4溶液可提纯蛋白质
②蛋白质的分子能透过半透膜
③蛋白质水解的最终产物是氨基酸
④温度越高,酶对某些化学反应的催化效率越高
⑤任何结构的蛋白质遇到浓HNO3都会变黄色.
| A. | ①②③ | B. | ②③⑤ | C. | ③④⑤ | D. | ②④⑤ |
分析 ①向蛋白质溶液里加浓(NH4)2SO4溶液可使蛋白质发生盐析;
②蛋白质的分子在水溶液中形成的是胶体;
③蛋白质是氨基酸的脱水缩合物;
④酶属于蛋白质;
⑤含苯环的蛋白质遇到浓HNO3才会变黄色.
解答 解:①向蛋白质溶液里加浓(NH4)2SO4溶液可使蛋白质发生盐析,能使蛋白质以沉淀的形式析出,从而能用于蛋白质的提纯,故①正确;
②蛋白质的分子在水溶液中形成的是胶体,故不能透过半透膜,故②错误;
③蛋白质是氨基酸的脱水缩合物,故蛋白质水解的最终产物是氨基酸,故③正确;
④酶属于蛋白质,温度过高会使其变性从而失去生理活性,故不是温度越高催化效率越高,故④错误;
⑤含苯环的蛋白质遇到浓HNO3才会变黄色,即不是所有的蛋白质均遇浓硝酸变黄,故⑤错误.
故选D.
点评 本题考查了蛋白质的结构和性质,应注意蛋白质盐析和变性的区别,可溶性的重金属盐使蛋白质变性,而浓的轻金属盐使其盐析.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
6.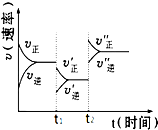 如图是可逆反应A(g)+2B(g)?2C(g)+3D(g),(正反应△H<0)的化学反应速率与化学平衡随外界条件改变而变化的关系图,下列条件的改变与图中情况相符的是( )
如图是可逆反应A(g)+2B(g)?2C(g)+3D(g),(正反应△H<0)的化学反应速率与化学平衡随外界条件改变而变化的关系图,下列条件的改变与图中情况相符的是( )
 如图是可逆反应A(g)+2B(g)?2C(g)+3D(g),(正反应△H<0)的化学反应速率与化学平衡随外界条件改变而变化的关系图,下列条件的改变与图中情况相符的是( )
如图是可逆反应A(g)+2B(g)?2C(g)+3D(g),(正反应△H<0)的化学反应速率与化学平衡随外界条件改变而变化的关系图,下列条件的改变与图中情况相符的是( )| A. | t1时,降低了温度 | |
| B. | t2时,加了催化剂 | |
| C. | t2时,增大了压强 | |
| D. | t1时,减小了A或B的物质的量的浓度 |
11.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法不正确的是( )
| A. | 元素A、B组成的化合物常温下一定呈气态 | |
| B. | 一定条件下,元素C、D的最高价氧化物对应的水化物之间能发生反应 | |
| C. | 工业上常用电解法制备元素C、D、E的单质 | |
| D. | 化合物AE与CE含有不同类型的化学键 |
1.标准状况下,11.85克金属镁放入足量的盐酸溶液中,生成11.2L氢气.则金属镁中所含的杂质是( )
| A. | Al | B. | Na | C. | Zn | D. | Fe |
8.下列有关说法中正确的是( )
| A. | 168O、178O、188O属于同位素 | |
| B. | N60和N2互为同系物 | |
| C. | O2和O3、H2和D2、H218O和H216O都互为同素异形体 | |
| D. | CH2O2、C2H4O2、C3H6O2、C4H8O2互为同系物;乙二醇、丙三醇也互为同系物 |
5.2016年3•15晚会曝光:“北口义齿”用废钢料制造假牙,经过反复回收再利用的这种“碎钢”,有害元素浓度越来越高,危害人体!而纯钛、钴铬、诺必灵等都是正规的义齿金属原料.钛合金烤瓷牙是目前国内使用最为普遍的一种烤瓷牙.
(1)TiCl4是生产金属钛和钛白的原料,工业上主要用TiO2氯化的方法来制取.
①有人拟用以下氯化反应来制取TiCl4:TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g)△H=+151kJ/mol,你认为这一氯化反应是否可自发进行?理论根据是什么?反应不能自发进行,因为此反应中△H>0,△S<0,△G=△H-T•△S>0,故此反应不能自发进行.
②工业上通常往TiO2和Cl2反应体系中加入碳单质,在一定条件下制取TiCl4,从化学平衡的角度解释此方法能顺利制取TiCl4的原因加入的碳单质与氧气反应,减小了产物O2的浓度,使TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g)平衡向正反应方向移动,使反应能够顺利进行.
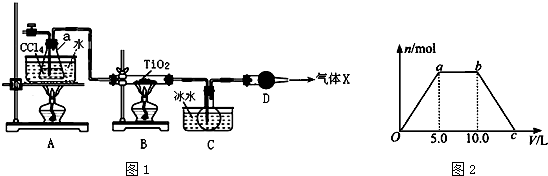
(2)某化学实验小组以TiO2和足量 CCl4为原料制取TiCl4,装置图如图1:
表是有关物质的性质:
请回答下列问题:
①实验开始时先点燃A处的酒精灯,待C中烧瓶里有液滴出现时再点燃B处的酒精灯,其主要目的是先排尽系统(装置)中的空气.
②本实验中仪器a采用题给的加热方式的突出优点是受热均匀,能为反应提供稳定的CCl4蒸汽流.
③B中TiO2发生反应的化学方程式是TiO2+CCl4$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4+CO2↑.
④欲分离C装置中的TiCl4,应采用的实验操作为蒸馏(填操作名称).
⑤若将反应过程中生成的气体X(足量)缓缓通入Ba( OH)2和NaOH的混合稀溶液中,生成沉淀的物质的量(n)和 通入气体X的体积(V)的关系如图2所示,则混合稀溶液中Ba( OH)2和NaOH的物质的量之比为1:1; 从a点到b点依次发生的第一个反应的离子方程式是CO2+2OH-=CO32-+H2O.
(1)TiCl4是生产金属钛和钛白的原料,工业上主要用TiO2氯化的方法来制取.
①有人拟用以下氯化反应来制取TiCl4:TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g)△H=+151kJ/mol,你认为这一氯化反应是否可自发进行?理论根据是什么?反应不能自发进行,因为此反应中△H>0,△S<0,△G=△H-T•△S>0,故此反应不能自发进行.
②工业上通常往TiO2和Cl2反应体系中加入碳单质,在一定条件下制取TiCl4,从化学平衡的角度解释此方法能顺利制取TiCl4的原因加入的碳单质与氧气反应,减小了产物O2的浓度,使TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g)平衡向正反应方向移动,使反应能够顺利进行.
(2)某化学实验小组以TiO2和足量 CCl4为原料制取TiCl4,装置图如图1:

表是有关物质的性质:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76.8 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
①实验开始时先点燃A处的酒精灯,待C中烧瓶里有液滴出现时再点燃B处的酒精灯,其主要目的是先排尽系统(装置)中的空气.
②本实验中仪器a采用题给的加热方式的突出优点是受热均匀,能为反应提供稳定的CCl4蒸汽流.
③B中TiO2发生反应的化学方程式是TiO2+CCl4$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4+CO2↑.
④欲分离C装置中的TiCl4,应采用的实验操作为蒸馏(填操作名称).
⑤若将反应过程中生成的气体X(足量)缓缓通入Ba( OH)2和NaOH的混合稀溶液中,生成沉淀的物质的量(n)和 通入气体X的体积(V)的关系如图2所示,则混合稀溶液中Ba( OH)2和NaOH的物质的量之比为1:1; 从a点到b点依次发生的第一个反应的离子方程式是CO2+2OH-=CO32-+H2O.