题目内容
8.写出下列物质在水中电离的方程式:(1)氢硫酸H2S:H2S?H++HS-,HS-?H++S2-.
(2)氢氧化铝Al(OH)3:Al(OH)3?Al3++3OH-.
(3)碳酸氢钠NaHCO3:NaHCO3=Na++HCO3-.
(4)硫酸氢钠NaHSO4:NaHSO4=Na++H++SO42-.
分析 电强电解质完全电离应等号,弱电解质部分电离,用可逆号,多元弱酸分步电离,以第一步为主,多元弱酸的酸式根离子不能拆,硫酸氢钠水溶液中完全电离,据此解答.
解答 解:(1)硫化氢为多元弱酸,分步电离,电离方程式:H2S?H++HS-,HS-?H++S2-;
故答案为:H2S?H++HS-,HS-?H++S2-;
(2)氢氧化铝为弱电解质,部分电离生成铝离子和氢氧根离子,电离方程式:Al(OH)3?Al3++3OH-;
故答案为:Al(OH)3?Al3++3OH-;
(3)碳酸氢钠为强电解质,完全电离,电离方程式:NaHCO3=Na++HCO3-;
故答案为:NaHCO3=Na++HCO3-;
(4)硫酸氢钠为强电解质,完全电离,电离方程式:NaHSO4=Na++H++SO42-;
故答案为:NaHSO4=Na++H++SO42-;
点评 本题考查了电解质电离方程式,分清电解质的强弱是解题关键,注意多元弱酸分步电离,题目难度不大.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
18.实验室通过简单的“试管实验”,即可探索元素的金属性、非金属性的强弱,请你选用下列试剂,根据实验要求完成下表.
试剂:①镁条、②铝条、③氯水、④AlCl3溶液、⑤MgCl2溶液、⑥NaBr溶液、⑦氢硫酸、⑧水、⑨NaOH溶液.
| 实验方案(只要求填写选用试剂) | ① | ② |
| 填试剂序号 | 填试剂序号 | |
| 实验现象 | 一支试管中有白色沉淀,另一支试管中先生成白色沉淀,后白色沉淀消失 | 溶液由无色变为黄色(或橙黄) |
| 有关反应的离子方程式 | ①Al3++3OH-═Al(OH)3↓ ②Al(OH)3+OH-═AlO2-+H2O 或③Al3++4OH-═AlO2-+2H2O ④Mg2++2OH-═Mg(OH)2↓ | Cl2+2Br-=2Cl-+Br2 |
| 结论 | 金属性:Mg>Al | 非金属性:Cl>Br |
19.反应N2(g)+3H2(g)?2NH3(g)在密闭容器中进行.下列关于该反应的说法正确的是( )
| A. | 加热能减慢反应速率 | |
| B. | 增大压强能加快反应速率 | |
| C. | 反应达到平衡时,v(正反应)=v(逆反应)=0 | |
| D. | 反应达到平衡时,N2转化率为100% |
16.下列叙述正确的是( )
| A. | CH4和CH3CH2CH2CH3分子组成相差2个-CH2-,因此二者是同系物 | |
| B. | 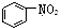 是芳香烃 是芳香烃 | |
| C. | 醇类的官能团是-CHO | |
| D. | 凡是含有碳元素的化合物都属于有机物 |
13.在溶液中能大量共存的一组离子或分子是( )
| A. | NH4+、H+、NO3-、HCO3- | B. | K+、Al3+、SO42-、氨水 | ||
| C. | Ba2+、K+、Cl-、SO42- | D. | Na+、SO42-、CO32-、OH- |
