题目内容
3.(1)在我国使用最早的合金是青铜,目前用量最大,用途最广泛的合金是钢.(2)0.5mol H2O 的质量为9g,共有9.03×1023个原子.
(3)质量都是50g 的Cl2、NH3、CO2、O2 四种气体中,含有分子数最少的是Cl2;在相同的温度和压强下,体积最大的是NH3.
(4)配制100mL 0.2mol/L CuSO4溶液,需要CuSO4•5H2O5g.
(5)在配制硫酸亚铁溶液时,常常加入铁粉,请说明原因2Fe3++Fe=3Fe2+(用离子方程式表示)
(6)过氧化钠跟水反应的化学方程式是2Na2O2+2H2O=4NaOH+O2↑.
分析 (1)在我国使用最早的合金是青铜,目前用量最大,用途最广泛的合金是钢;
(2)根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$结合分子的构成计算;
(3)根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$=$\frac{V}{Vm}$计算该题相关物理量;
(4)根据n=cV计算CuSO4的物质的量,蓝矾物质的量等于CuSO4的物质的量,根据m=nM计算需要蓝矾的质量;
(5)亚铁离子易被氧化;
(6)过氧化钠与水反应生成氢氧化钠和氧气.
解答 解:(1)在我国使用最早的合金是青铜,目前用量最大,用途最广泛的合金是钢,故答案为:青铜(或铜合金、铜);钢(或铁合金、铁);
(2)m(H2O)=0.5mol×18g.mol=9g,N(H2O)=0.5mol×NA/mol=0.5NA,含有的原子个数总共为1.5mol×3×NA/mol=1.5NA,故答案为:9;9.03×1023(或1.5×6.02×1023、1.5NA);
(3)根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$,相同质量时,气体的摩尔质量越大,物质的量越小,则分子数越少,因M(Cl2)>M(CO2)>M(O2)>M(NH3),则含有分子数目最少的是Cl2,根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$=$\frac{V}{Vm}$,可知,相同质量时,气体的摩尔质量越大,物质的量越小,在相同温度和相同压强条件下,气体的体积越小,反之越大,则体积最大的是NH3,
故答案为:Cl2;NH3;
(4)配制0.2mol/L的CuSO4溶液100ml,需要CuSO4的物质的量=0.1L×0.2mol/L=0.02mol,蓝矾物质的量等于CuSO4的物质的量,故需要蓝矾的质量=0.02mol×250g/mol=5g,故答案为:5;
(5)配制硫酸亚铁溶液时,常常加入铁粉,是因亚铁离子易被氧化,则加入铁发生2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+;
(6)过氧化钠与水反应的化学方程式是:2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑.
点评 本题考查溶液配制、物质的量浓度和阿伏伽德罗常数有关计算,比较基础,注意根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$=$\frac{V}{Vm}$解题.

| A. | 参加反应的硝酸是0.92 mol | |
| B. | 合金中镁的质量5.9 g | |
| C. | 反应过程中转移的电子数为0.46 mol | |
| D. | 合金中含有铜0.092 mol |
| A. | Na2O2 | B. | H2O | C. | MgCl2 | D. | N2 |
| A. | 自发反应都是放热反应 | B. | 自发反应都是熵增加的反应 | ||
| C. | 自发反应都是△G<0的反应 | D. | 自发反应都是△G>0的反应 |
| A. | 2 种 | B. | 3种 | C. | 4种 | D. | 5种 |
| A. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 氯气和消石灰反应可以制得漂粉精 | |
| C. | Al2O3的熔点很高,可用于制作耐高温材料 | |
| D. | 用氧化钠作为呼吸面具和潜水艇的供氧剂 |
| A. | 需要用托盘天平称量NaOH固体的质量为1.92g | |
| B. | 将NaOH固体在小烧杯中加水溶解后立即倒入容量瓶中并进行定容 | |
| C. | 在容量瓶中定容时俯视容量瓶刻度线会使溶液浓度偏高 | |
| D. | 定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线 |
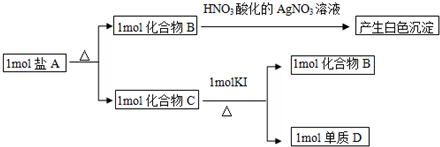
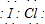 ,该化合物中显正价的是I元素.
,该化合物中显正价的是I元素.