题目内容
4.把2.0mol/LCuSO4溶液和1.0mol/LH2SO4溶液等体积混合(假设混合后溶液的体积等于两种溶液体积之和).计算(1)混合溶液中CuSO4的物质的量浓度为多少?
(2)混合溶液中H+、SO42-的物质的量浓度为多少?
(3)向溶液中加入足量铁粉,经足够长的时间后,铁粉有剩余.此时溶液中Fe2+的物质的量浓度为多少?
分析 (1)根据稀释定律,稀释前后溶质的物质的量不变,据此计算混合溶液中CuSO4物质的量浓度;
(2)混合后溶液中c(H+)=2c(H2SO4);溶液中硫酸根来源于硫酸铜与硫酸电离,故 c(SO42-)=c(CuSO4)+c(H2SO4);
(3)向溶液中加入铁粉,经过足够长的时间,铁粉有剩余,则硫酸铜、硫酸都完全反应,此时溶液中溶质为FeSO4,故c(Fe2+)=c(SO42-).
解答 解:(1)把2.0mol•L-1CuSO4和1.0mol•L-1H2SO4溶液等体积混合,根据稀释定律,稀释前后溶质的物质的量不变,则混合后溶液中c(CuSO4)=$\frac{1}{2}$×2.0mol/L=1.0 mol/L,c(H2SO4)=$\frac{1}{2}$×1.0mol/L=0.5mol/L,
答:混合溶液中CuSO4的物质的量浓度为1.0 mol/L;
(2)混合后溶液中c(H+)=2c(H2SO4)=2×0.5mol/L=1mol/L,溶液中硫酸根来源于硫酸铜与硫酸电离,故c(SO42-)=c(CuSO4)+c(H2SO4)=1mol/L+0.5mol/L=1.5mol/L,
答:混合溶液中H+、SO42-的物质的量浓度分别为1mol/L,1.5mol/L;
(3)向溶液中加入铁粉,经过足够长的时间,铁粉有剩余,则硫酸铜、硫酸都完全反应,此时溶液中溶质为FeSO4,故c(Fe2+)=c(SO42-)=1.5mol/L,
答:此时溶液中Fe2+的物质的量浓度为1.5mol/L.
点评 本题考查物质的量浓度的有关计算,比较基础,注意对公式的理解与灵活运用,注意理解稀释定律.

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
5.根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 测定等浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
| B | 向淀粉NaI溶液中加入氯水 | 溶液变蓝 | 氧化性:C12>I2 |
| C | 向等浓度的KCl、KI混合液中滴加AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| D | 在酒精灯上加热铝箔 | 铝箔熔化但不滴落 | 熔点:氧化铝>铝 |
| A. | A | B. | B | C. | C | D. | D |
6.下列说法中不正确的是( )
| A. | 浓度均为0.1mol•L-1的小苏打溶液与烧碱溶液等体积混合:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-) | |
| B. | pH相同的盐酸和硫酸,分别用蒸馏水稀释至原体积的m倍和n倍,稀释后两溶液pH相等,则m>n | |
| C. | 常温下,0.1mol•L-1某一元酸HA在水中有0.1%发生电离,则该温度下HA的电离常数约为10-7 | |
| D. | 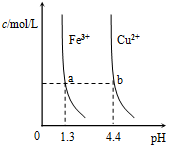 某温度下,Fe(OH)3,Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度的变化如图.由图可知:Ksp[Fe(OH)3]<K[Cu(OH)2] |
12.为了测定K2CO3和NaHCO3混合物的组成,某学生每次称取一定质量的混合物溶于水配成溶液,向其中加入相同浓度的Ba(OH)2溶液,每次实验均充分反应,实验结果记录如表:
请回答下列问题:
(1)第二次实验中产生沉淀的质量是5.516g;
(2)求所用Ba(OH)2的溶液的物质的量浓度0.112 g•mol-1;
(3)求混合物中K2CO3和NaHCO3的物质的量之比5:2;
(4)在25℃时,取下第3组实验所得溶液体积的$\frac{1}{10}$,加水配成1000mL溶液,求此溶液pH=12.
| 实验次数 | 混合物的质量/g | 所加Ba(OH)2溶液的体积/L | 测得沉淀的质量/g |
| 1 | 1.716 | 0.5 | 2.758 |
| 2 | 3.432 | 0.5 | |
| 3 | 5.148 | 0.5 | 8.274 |
| 4 | 6.864 | 0.5 | 11.032 |
| 5 | 8.580 | 0.5 | 11.032 |
| 6 | 10.296 | 0.5 | 11.032 |
(1)第二次实验中产生沉淀的质量是5.516g;
(2)求所用Ba(OH)2的溶液的物质的量浓度0.112 g•mol-1;
(3)求混合物中K2CO3和NaHCO3的物质的量之比5:2;
(4)在25℃时,取下第3组实验所得溶液体积的$\frac{1}{10}$,加水配成1000mL溶液,求此溶液pH=12.
16.7.5g镁铝合金完全溶解于100mL密度为1.40g/mL、质量分数为63%的浓硝酸中得到NO2和NO的混合气体11.2L(标准状况),向反应后的溶液中加入3.0mol/LNaOH溶液,当金属离子恰好完全沉淀时,得到19.4g沉淀,下列说法不正确的是( )
| A. | 该合金中铝与镁的物质的量之比是2:1 | |
| B. | 该浓硝酸中HNO3的物质的量浓度是14.0mol/L | |
| C. | NO2和NO的混合气体中,NO的体积分数是20% | |
| D. | 得到19.4g沉淀时,加入NaOH溶液的体积是300mL |
13.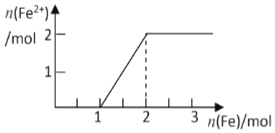 现有NaNO3和HCl的混合溶液500mL,其物质的量浓度分别为2mol/L和10mol/L,向混合溶液中逐渐加入过量的Fe粉,回答下列问题(假设反应中HNO3被还原成NO) ( )
现有NaNO3和HCl的混合溶液500mL,其物质的量浓度分别为2mol/L和10mol/L,向混合溶液中逐渐加入过量的Fe粉,回答下列问题(假设反应中HNO3被还原成NO) ( )
 现有NaNO3和HCl的混合溶液500mL,其物质的量浓度分别为2mol/L和10mol/L,向混合溶液中逐渐加入过量的Fe粉,回答下列问题(假设反应中HNO3被还原成NO) ( )
现有NaNO3和HCl的混合溶液500mL,其物质的量浓度分别为2mol/L和10mol/L,向混合溶液中逐渐加入过量的Fe粉,回答下列问题(假设反应中HNO3被还原成NO) ( )| A. | 能溶解铁粉的最大质量为84g | |
| B. | 反应生成气体的体积为33.6L(标准状况下) | |
| C. | 溶液中Fe2+的物质的量变化曲线如图所示 | |
| D. | 将反应后的混合物过滤,滤液蒸发结晶所得固体为NaCl和FeCl2的混合物 |
14.乙烯的产量是衡量一个国家石油化工发展水平的重要标志.下列表述正确的是( )
| A. | 乙烯的电子式是 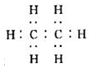 | B. | 乙烯的结构式为CH2CH2 | ||
| C. | 乙烯分子中所有原子共平面 | D. | 5.6L乙烯气体中含有1mo1C-H键 |