题目内容
9.有一种“水”电池,在海水中电池总反应可表示为行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是( )| A. | 正极反应式:Ag+Cl--e-=AgCl | |
| B. | Na+不断向“水”电池的负极移动 | |
| C. | 每生成1molNa2Mn5O10转移2mol电子 | |
| D. | AgCl是还原产物 |
分析 根据电池总反应可判断出反应中Ag的化合价升高,被氧化,Ag应为原电池的负极,AgCl是氧化产物;方程式中5MnO2生成1Na2Mn5O10,化合价共降低了2价,所以每生成1molNa2Mn5O10转移2mol电子;在原电池中阴离子向负极移动,阳离子向正极移动,以形成闭合电路.
解答 解:A、根据电池总反应:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,可判断出Ag应为原电池的负极,负极发生反应的电极方程式为:Ag+Cl--e-=AgCl,而不是正极方程式,故A错误;
B、在原电池中阴离子向负极移动,阳离子向正极移动,故B错误;
C、根据方程式中5MnO2生成1Na2Mn5O10,化合价共降低了2价,所以每生成1molNa2Mn5O10转移2mol电子,故C正确;
D、反应中Ag的化合价升高,被氧化,Ag应为原电池的负极,AgCl是氧化产物,故D错误.
故选:C.
点评 本题考查原电池的电极反应和离子的定向移动以及电化学的简单计算,做题时要注意总电池反应式的判断利用,运用两极上的反应特点做题,分析Mn元素的化合价变化是该题的难点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.由两种金属组成的混合物4.8g,跟氯气完全反应时,消耗氯气2.24L(标准状况),则混合物的组成可能是( )
| A. | 镁和铁 | B. | 钠和铁 | C. | 锌和铜 | D. | 铁和铜 |
4.a、b、c、d、e是原子序数依次增大的五种短周期主族元素.b、c、e最外层电子数之和为10;a原子核外最外层电子数是次外层的2倍;c是同周期中原子半径最大的元素;工业上一般通过电解氧化物的方法制备d的单质;e的单质是制备太阳能电池的重要材料.下列说法正确的是( )
| A. | a能将e从其氧化物中置换出来,因此非金属性a>e | |
| B. | b元素的气态氢化物易液化,是因为其分子间能形成氢键 | |
| C. | 工业上不用电解氯化物的方法制备单质d是由于其氯化物的熔点高 | |
| D. | 相同质量的c和d单质分别与足量稀盐酸反应,前者生成的氢气多 |
14.乙烯的产量是衡量一个国家石油化工发展水平的重要标志.下列表述正确的是( )
| A. | 乙烯的电子式是 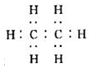 | B. | 乙烯的结构式为CH2CH2 | ||
| C. | 乙烯分子中所有原子共平面 | D. | 5.6L乙烯气体中含有1mo1C-H键 |
1.2012年2月新华网报道,加拿大开发出生产医用放射性同位素${\;}_{43}^{99}$Tc的简单方法.下列关于${\;}_{43}^{99}$Tc的叙述正确的是( )
| A. | 原子序数是99 | B. | 质量数是43 | C. | 质子数是56 | D. | 中子数是56 |
18.下列化学用语或模型表示正确的是( )
| A. | NH3分子结构式: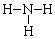 | B. | 氚原子符号:21H | ||
| C. | Mg2+离子的电子式:Mg: | D. | C2H4分子比例模型: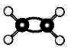 |
19.元素的种数与原子的种数相比( )
| A. | 前者多 | B. | 后者多 | C. | 一样多 | D. | 无法确定 |
 NaCl
NaCl .
.