题目内容
14.实验室里常用浓盐酸跟高锰酸钾反应来制取少量氯气,反应的化学方程式为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O.
(1)将上述方程式改写为离子方程式:2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+8H2O.
(2)反应中体现了浓盐酸的还原性、酸性.(填性质)
(3)若反应中产生了的Cl2气体的体积 (标准状况下)为4.48L,则该反应中转移电子的物质的量是0.4mol,作氧化剂的浓盐酸是0mol.
分析 (1)在改写为离子方程式时,能拆的物质由强酸、强碱和可溶性盐;
(2)在此反应中,浓盐酸部分被氧化为氯气,部分形成了盐;
(3)求出氯气的物质的量,然后根据氯气中的氯元素是由-1价变为0价来分析;在此反应中,浓盐酸做还原剂和酸.
解答 解:(1)在改写为离子方程式时,能拆的物质由强酸、强碱和可溶性盐,故能拆的物质为高锰酸钾、盐酸、KCl和MnCl2,故离子方程式为:2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+8H2O,故答案为:2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+8H2O;
(2)在此反应中,10mol浓盐酸被氧化为氯气,做还原剂,显示还原性;6mol盐酸形成了盐,做了酸,显示酸性,故此反应体现了盐酸的还原性和酸性,故答案为:还原性和酸性;
(3)标况下4.48L氯气的物质的量为0.2mol,而氯气中的氯元素是由-1价变为0价,故当生成0.2mol氯气时转移0.4mol电子;在此反应中,浓盐酸做还原剂和酸,不做氧化剂,故做氧化剂的盐酸为0mol,故答案为:0.4;0.
点评 本题考查了离子方程式的书写和根据反应来判断反应中物质的作用以及转移的电子的物质的量,难度不大,注意基础的掌握.

练习册系列答案
相关题目
5.下列各组物质之间的化学反应,反应产物一定为纯净物的是( )
| A. | CH3-CH=CH-CH3+Br2$→_{△}^{催化剂}$ | |
| B. | CH2=CH-CH2CH3+HCl | |
| C. | CH3-CH=CH2+H2O $→_{加热、加压}^{催化剂}$ | |
| D. | CH3CH3+Cl2$\stackrel{光照}{→}$ |
2.硼氢化钠(NaBH4)在有机合成、化工生产方面有广泛应用.制备硼氢化钠的化学方程式为NaBO2+2Si02+4Na+2H2?NaBH4+2Na2SiO3.下列有关上述反应的说法错误的是( )
| A. | 氧化产物和还原产物的物质的量之比为2:1 | |
| B. | 转移4 mol电子时,只需向装置中通人44.8 L H2(标准状况) | |
| C. | 装药品之前加热装置至100℃并持续一会儿 | |
| D. | 制备硼氢化钠的副产物可能有NaH |
9.已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O.每有1mol Cu(IO3)2参加反应时( )
| A. | 有12 mol KI 被氧化 | B. | 转移11 mol电子 | ||
| C. | 生成CuI 382g | D. | I2只是氧化产物 |
19.已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的有( )
①生成物的质量分数一定增加
②生成物的产量一定增大
③反应物的转化率一定增大
④正反应速率一定大于逆反应速率
⑤反应物的浓度一定降低
⑥使用了合适的催化剂.
①生成物的质量分数一定增加
②生成物的产量一定增大
③反应物的转化率一定增大
④正反应速率一定大于逆反应速率
⑤反应物的浓度一定降低
⑥使用了合适的催化剂.
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
3.向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素.下列说法正确的是( )
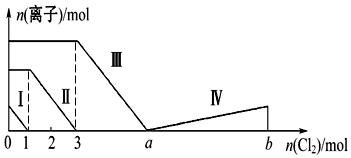

| A. | 线段Ⅱ表示Br-的变化情况 | B. | 原溶液中n(FeBr2):n(FeI2)=1:3 | ||
| C. | 线段Ⅳ表示IO3-的变化情况 | D. | 根据图象无法计算a的值 |