题目内容
4.如果你家里的食用菜油混有水分,你将采用下列何种方法分离( )| A. | 过滤 | B. | 蒸馏 | C. | 分液 | D. | 萃取 |
分析 食用菜油与水分层,选择分液法分离,以此来解答.
解答 解:食用菜油与水分层,选择分液法分离,过滤分离不溶性固体与液体、蒸馏分离互溶但沸点不同的液体、萃取分离溶质在不同溶剂中溶解性差异大的混合物,
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意分离原理及方法选择,题目难度不大.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
15.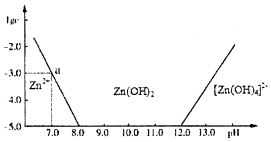 锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性.
锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性.
(1)下图表示常温下二价锌在水溶液中的存在形式与pH的关系,横坐标为溶液的pH值,纵坐标为Zn2+离子或[Zn(OH)4]2-离子物质的量浓度的对数,回答下列问题:
①将单质Zn加入足量的氢氧化钠溶液中,反应的离子方程式可表示为Zn2++4OH-═[Zn(OH)4]2-
②从图中数据计算可得Zn(OH)2的溶度积(Ksp)=10-17.
③往1L 1.00mol•L-1ZnCl2溶液中加入NaOH固体至pH=6,需NaOH1.80mol.
④己知:往ZnCl2溶液中加入硝酸铅或醋酸铅溶液可以制得PbCl2白色晶体;25℃时,PbCl2固体在盐酸中的溶解度如表:
根据上表数据判断下列说法正确的是C D.
A.随着盐酸浓度的增大,PbCl2固体的溶解度变小
B.PbCl2固体在0.50mol•L-1盐酸中的Ksp小于在纯水中的Ksp
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子)
D.PbCl2固体可溶于饱和食盐水
(2)氢氧化锌与氢氧化铝的性质又存在一定的差异,如氢氧化铝不溶于氨水,而氢氧化锌 能溶于氨水,生成配合物离子[Zn(NH3)4]2+.
①在25℃下,将a mol•L-1的NH4Cl溶液与0.01mol•L-1的NaOH溶液等体积混合,反应后测得溶液pH=7,用含a的代数式表示NH4+的水解常数Kh=10-5(a-0.01)mol•L-1.
②若25℃时将浓度均为0.1mo1.L-1的NH4Cl、NH3•H2O溶液等体积混合后,溶液呈碱性,则关于该溶液的说法不正确的是bc(填字母).
a.此溶液一定有c(NH4+)+c(H+)=c(OH-)+c(Cl-)
b.此溶液一定有c(C1-)=c(NH3•H2O)+c(NH4+)
c.混合溶液中水的电离程度一定大于该温度下纯水的电离程度
d.此溶液加入少量氢氧化钠或盐酸,溶液的pH变化不大.
 锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性.
锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性.(1)下图表示常温下二价锌在水溶液中的存在形式与pH的关系,横坐标为溶液的pH值,纵坐标为Zn2+离子或[Zn(OH)4]2-离子物质的量浓度的对数,回答下列问题:
①将单质Zn加入足量的氢氧化钠溶液中,反应的离子方程式可表示为Zn2++4OH-═[Zn(OH)4]2-
②从图中数据计算可得Zn(OH)2的溶度积(Ksp)=10-17.
③往1L 1.00mol•L-1ZnCl2溶液中加入NaOH固体至pH=6,需NaOH1.80mol.
④己知:往ZnCl2溶液中加入硝酸铅或醋酸铅溶液可以制得PbCl2白色晶体;25℃时,PbCl2固体在盐酸中的溶解度如表:
| C(HCl)/(mol•L-1) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
| C(PbCl2)/(mol•L-1)×10-3 | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
A.随着盐酸浓度的增大,PbCl2固体的溶解度变小
B.PbCl2固体在0.50mol•L-1盐酸中的Ksp小于在纯水中的Ksp
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子)
D.PbCl2固体可溶于饱和食盐水
(2)氢氧化锌与氢氧化铝的性质又存在一定的差异,如氢氧化铝不溶于氨水,而氢氧化锌 能溶于氨水,生成配合物离子[Zn(NH3)4]2+.
①在25℃下,将a mol•L-1的NH4Cl溶液与0.01mol•L-1的NaOH溶液等体积混合,反应后测得溶液pH=7,用含a的代数式表示NH4+的水解常数Kh=10-5(a-0.01)mol•L-1.
②若25℃时将浓度均为0.1mo1.L-1的NH4Cl、NH3•H2O溶液等体积混合后,溶液呈碱性,则关于该溶液的说法不正确的是bc(填字母).
a.此溶液一定有c(NH4+)+c(H+)=c(OH-)+c(Cl-)
b.此溶液一定有c(C1-)=c(NH3•H2O)+c(NH4+)
c.混合溶液中水的电离程度一定大于该温度下纯水的电离程度
d.此溶液加入少量氢氧化钠或盐酸,溶液的pH变化不大.
19.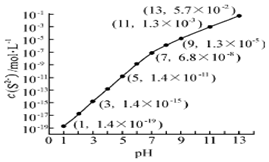 自然界中存在着S元素,它对生物具有重要的作用.
自然界中存在着S元素,它对生物具有重要的作用.
(1)①硫离子的电子式为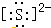 .
.
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与铜反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
(2)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发),
①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1.
②某溶液含0.020mol•L-1Mn2+、0.10mol•L-1H2S,当溶液pH=5时,Mn2+开始沉淀.[已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如表.
①等浓度的NaHSO3和Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(H+)>c(HSO3-)>c(OH-).
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
 自然界中存在着S元素,它对生物具有重要的作用.
自然界中存在着S元素,它对生物具有重要的作用.(1)①硫离子的电子式为
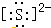 .
.②加热时,硫元素的最高价氧化物对应水化物的浓溶液与铜反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
(2)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发),
①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1.
②某溶液含0.020mol•L-1Mn2+、0.10mol•L-1H2S,当溶液pH=5时,Mn2+开始沉淀.[已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如表.
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
16.某有机物的结构简式为 ,与其互为同分异构体的是( )
,与其互为同分异构体的是( )
 ,与其互为同分异构体的是( )
,与其互为同分异构体的是( )| A. |  | B. |  | C. |  | D. |  |
13.某化学电源的工作原理如图.下列说法不正确的是( )
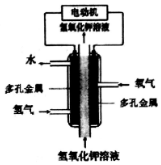

| A. | 采用多孔金属作电极可增大电极接触面积,提高对气体的吸附能力 | |
| B. | 通H2的电极作负极,发生氧化反应 | |
| C. | 通O2的电极发生的电极反应:O2+4e-+4H+=2H2O | |
| D. | 该电池工作时发生的主要能量转化形式为化学能转化为电能和热能 |
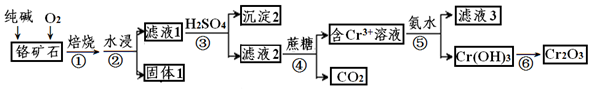
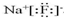 ,
, O2-
O2- .
.
 .
. (填结构简式).
(填结构简式). .
.