题目内容
12.在下列物质中:①Na ②Fe(OH)2固体③Na2O固体 ④CO2 ⑤FeCl3溶液 ⑥蔗糖溶液 ⑦熔融MgSO4⑧NaCl晶体(请用序号填空).属于氧化物的是③④,属于盐的是⑦⑧,属于电解质的是②③⑦⑧,能导电的是①⑤⑦.
分析 由两种元素组成、其中一种为氧元素的为氧化物;
阴离子是酸根离子、阳离子是金属离子或铵根离子的化合物为盐;
在水溶液中或熔融状态下能导电的化合物为电解质;
有自由移动的电子或离子的物质能导电.
解答 解:①Na是单质,能导电,但不是氧化物、盐和电解质;
②Fe(OH)2固体不能导电,是电解质;
③Na2O固体不能导电,是氧化物,是电解质;
④CO2 不能导电,是氧化物;
⑤FeCl3溶液能导电,是混合物,故不是氧化物、盐和电解质;
⑥蔗糖溶液不能导电,是混合物,既不是氧化物、也不是盐和电解质;
⑦熔融MgSO4能导电,是盐,是电解质;
⑧NaCl晶体不能导电,是盐,是电解质.
故是氧化物的是③④,是盐的是⑦⑧,是电解质的是②③⑦⑧,能导电的是①⑤⑦.
故答案为:③④;⑦⑧;②③⑦⑧;①⑤⑦.
点评 本题考查了氧化物、盐、电解质和能导电的物质的判断,应注意的是电解质不一定能导电,能导电的不一定是电解质.

练习册系列答案
相关题目
2.下列实验操作的描述中,正确的是( )
| A. | 过滤时,慢慢地将液体直接倒入过滤器中 | |
| B. | 在食盐溶液蒸发结晶的过程中,当蒸发皿中出现较多量固体时即停止加热 | |
| C. | 酒精灯不慎碰倒起火时可用水扑灭 | |
| D. | 先在天平两个托盘上各放一张相同质量的纸,再把NaOH固体放在纸上称量 |
3.下列现象是因为发生取代反应的是( )
| A. | 乙烯使酸性KMnO4溶液褪色 | |
| B. | 乙烯使溴水褪色 | |
| C. | 点燃乙烯出现黑烟 | |
| D. | 甲烷与氯气的混合气体,光照一段时间后褪色 |
20.下列说法正确的是( )
| A. | CuSO4•5H2O是一种纯净物 | |
| B. | 溶于水后能电离出氢离子的化合物一定是酸 | |
| C. | 氯化钠溶液在电流作用下电离成钠离子和氯离子 | |
| D. | SO3、NH3的水溶液均能导电,所以均是电解质 |
7.25℃时加水稀释10mL pH=11的氨水,下列判断正确的是( )
| A. | 原氨水的浓度为10-3mol•L-1 | |
| B. | 溶液中$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$减小 | |
| C. | 氨水的电离程度增大,溶液中所有离子的浓度均减小 | |
| D. | 再加入10 mL pH=3的盐酸充分反应后混合液的pH值肯定大于7 |
17.下列说法错误的是( )
| A. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| B. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| C. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| D. | 古剑“湛泸”“以剂钢为刃,剂钢指的是铁的合金 |
4.下列依据热化学方程式得出的结论正确的是( )
| A. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1,则含20.0 g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于28.65kJ | |
| B. | 已知2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ•mol-1,则标况下1mol氢气完全燃烧放出241.8 kJ的热量 | |
| C. | 已知2C(s)+2O2(g)=2CO2(g)△H=a kJ•mol-1,2C(s)+O2(g)=2CO(g)△H=b kJ•mol-1,则a>b | |
| D. | 已知P (白磷,s)=P (红磷,s)△H<0,则白磷比红磷稳定 |
15.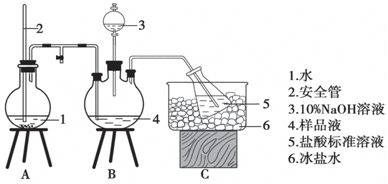 某小组以CoCl2•6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,进行如下实验.
某小组以CoCl2•6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,进行如下实验.
①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL c1 mol•L-1的盐酸标准溶液吸收.蒸氨结束后取下接收瓶,用c2 mol•L-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液.
②氯的测定
回答下列问题:
(1)装置中安全管的作用原理是使A瓶中压强稳定.
(2)用NaOH标准溶液滴定过剩的HCl时,应使用碱式滴定管,可使用的指示剂为酚酞或甲基橙.
(3)样品中氨的质量分数表达式为$\frac{(C{\;}_{1}V{\;}_{1}-C{\;}_{2}V{\;}_{2})×10{\;}^{-3}×17}{w}$×100%.
(4)测定氨前应该对装置进行气密性检查,若气密性不好测定结果将偏低(填“偏高”或“偏低”).
(5)氯的测定采用莫尔法,莫尔法是一种沉淀滴定法,用标准硝酸银溶液滴定,进行测定溶液中Cl-的浓度.已知:
①若用AgNO3溶液滴定待测液,可选为滴定指示剂的是C.
A.NaCl B.BaBr2 C.Na2CrO4 D.KSCN
②滴定终点的现象是滴入最后一滴标准溶液,生成砖红色沉淀,且30s 不复原.
 某小组以CoCl2•6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,进行如下实验.
某小组以CoCl2•6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,进行如下实验.①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL c1 mol•L-1的盐酸标准溶液吸收.蒸氨结束后取下接收瓶,用c2 mol•L-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液.
②氯的测定
回答下列问题:
(1)装置中安全管的作用原理是使A瓶中压强稳定.
(2)用NaOH标准溶液滴定过剩的HCl时,应使用碱式滴定管,可使用的指示剂为酚酞或甲基橙.
(3)样品中氨的质量分数表达式为$\frac{(C{\;}_{1}V{\;}_{1}-C{\;}_{2}V{\;}_{2})×10{\;}^{-3}×17}{w}$×100%.
(4)测定氨前应该对装置进行气密性检查,若气密性不好测定结果将偏低(填“偏高”或“偏低”).
(5)氯的测定采用莫尔法,莫尔法是一种沉淀滴定法,用标准硝酸银溶液滴定,进行测定溶液中Cl-的浓度.已知:
| 银盐 性质 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| 溶解度(mol•L-1) | 1.3410-6 | 7.110-7 | 1.110-8 | 6.510-5 | 1.010-6 |
A.NaCl B.BaBr2 C.Na2CrO4 D.KSCN
②滴定终点的现象是滴入最后一滴标准溶液,生成砖红色沉淀,且30s 不复原.