题目内容
7.25℃时加水稀释10mL pH=11的氨水,下列判断正确的是( )| A. | 原氨水的浓度为10-3mol•L-1 | |
| B. | 溶液中$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$减小 | |
| C. | 氨水的电离程度增大,溶液中所有离子的浓度均减小 | |
| D. | 再加入10 mL pH=3的盐酸充分反应后混合液的pH值肯定大于7 |
分析 A.一水合氨是弱电解质,在水溶液里部分电离;
B.加水稀释氨水,促进一水合氨电离,导致溶液中n(NH4+)增大、n(NH3.H2O)减小;
C.加水稀释促进一水合氨电离,溶液中c(H+)增大;
D.pH=3的盐酸浓度小于pH=11的氨水浓度,二者等体积混合,氨水过量,溶液呈碱性.
解答 解:A.一水合氨是弱电解质,在水溶液里部分电离,所以原氨水的浓度>10-3mol/L,故A错误;
B.加水稀释氨水,促进一水合氨电离,导致溶液中n(NH4+)增大、n(NH3.H2O)减小,则溶液中$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$增大,故B错误;
C.加水稀释促进一水合氨电离,溶液中c(OH-)减小,温度不变,则水的离子积常数不变,则溶液中c(H+)增大,故C错误;
D.常温下,pH=3的盐酸浓度小于pH=11的氨水浓度,二者等体积混合,氨水过量,一水合氨电离程度大于铵根离子水解程度,导致混合溶液呈碱性,则pH>7,故D正确;
故选D.
点评 本题考查了弱电解质的电离,明确弱电解质电离特点是解本题关键,注意稀释氨水过程中增大一水合氨电离程度但其电离平衡常数不变,溶液中c(H+)增大,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
18.下列应用或事实与胶体的性质没有关系的是( )
| A. | 在河流入海口处易形成三角州 | |
| B. | 在饱和氯化铁溶液中逐滴加入NaOH溶液,产生红褐色沉淀 | |
| C. | 尿毒症患者做“血液透析” | |
| D. | 用石膏或盐卤点制豆腐 |
2.下列说法不正确的是( )
| A. | 用石灰对煤燃烧后形成的烟气脱硫,并回收石膏符合节能减排的理念 | |
| B. | 自发反应也可能是熵减小的反应 | |
| C. | 二次电池放电过程中的反应属于自发反应 | |
| D. | 若C2H2的燃烧热为1300 kJ•mol-1,在其燃烧过程中每转移5NA个电子会放出1300 kJ的能量 |
19.下列叙述正确的是( )
| A. | 使用催化剂能够降低化学反应的反应热△H | |
| B. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和NH3•H2O反应的中和热△H=2×(-57.3)kJ/mol | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g)的△H=+2×283.0 kJ/mol |
10.室温下,0.l 000mol/L NaOH溶液滴定20.00mL某未知浓度的醋酸溶液,滴定曲线如图1.其中①点所示溶液中c(CH3COO-)=2c(CH3COOH),③点溶液中存在:c(CH3COO-)+c(CH3COOH)=c(Na+).
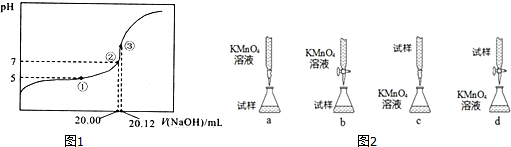
(1)滴定应该选用酚酞做指示剂
(2)该温度下CH3COOH的电离常数Ka=2×10-5,
(3)醋酸的实际浓度为0.1006mol/L(保留四位有效数字)
(4)下列情况可能引起测定结果偏高的是AC.
A、碱式滴定管未用标准溶液润洗
B、锥形瓶未用待测液润洗
C、滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
D、滴定前,滴定管中的溶液液面最低点在“0”点以下
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定、氧化还原滴定等.沉淀滴定所用的指示剂本身就是一种沉淀剂.已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
滴定时,你认为该滴定适宜选用的指示剂是下列中的D.
A.KBr B.KI C.K2S D.K2CrO4
(6)在酸性条件下,用KMnO4标准溶液进行氧化还原滴定,可以测定Fe2+的含量.反应的离子方程式是:Fe2++MnO4-+H+--Fe3++Mn2++H2O(未配平)图2四种滴定方式(夹持部分略去),你认为最合理的是b(填字母序号).判断滴定终点的依据滴入最后一滴KMnO4溶液恰好由棕黄色变紫色,且半分钟内不变色.

(1)滴定应该选用酚酞做指示剂
(2)该温度下CH3COOH的电离常数Ka=2×10-5,
(3)醋酸的实际浓度为0.1006mol/L(保留四位有效数字)
(4)下列情况可能引起测定结果偏高的是AC.
A、碱式滴定管未用标准溶液润洗
B、锥形瓶未用待测液润洗
C、滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
D、滴定前,滴定管中的溶液液面最低点在“0”点以下
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定、氧化还原滴定等.沉淀滴定所用的指示剂本身就是一种沉淀剂.已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×10-17 | 2.0×10-48 | 1.8×10-10 |
A.KBr B.KI C.K2S D.K2CrO4
(6)在酸性条件下,用KMnO4标准溶液进行氧化还原滴定,可以测定Fe2+的含量.反应的离子方程式是:Fe2++MnO4-+H+--Fe3++Mn2++H2O(未配平)图2四种滴定方式(夹持部分略去),你认为最合理的是b(填字母序号).判断滴定终点的依据滴入最后一滴KMnO4溶液恰好由棕黄色变紫色,且半分钟内不变色.
11.已知:H2O(g)═H2O(l)△H=Q1 kJ•mol-1
C2H5OH(g)═C2H5OH(l)△H=Q2 kJ•mol-1
C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=Q3 kJ•mol-1
若使46g酒精液体完全燃烧,最后恢复到室温,则放出的热量为( )
C2H5OH(g)═C2H5OH(l)△H=Q2 kJ•mol-1
C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=Q3 kJ•mol-1
若使46g酒精液体完全燃烧,最后恢复到室温,则放出的热量为( )
| A. | (Q1+Q2+Q3) kJ | B. | 0.5(Q+Q2+Q3) kJ | ||
| C. | (0.5Q1-1.5Q2+0.5Q3) kJ | D. | -(3Q1-Q2+Q3) kJ |