题目内容
2.碳和氮的化合物与人类生产、生活密切相关.(1)C、CO、CO2在实际生产中有如下应用:
a.2C+SiO2$\frac{\underline{\;高温\;}}{电炉}$Si+2CO
b.3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
c.C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2
d.CO2+CH4$\frac{\underline{\;催化剂\;}}{\;}$CH3COOH
上述反应中,理论原子利用率最高的是d.可用碳酸钾溶液吸收b中生成的CO2,常温下,pH=10的碳酸钾溶液中水电离的OH-的物质的量浓度为1×10-4 mol•L-1,常温下,0.1mol•L-1KHCO3溶液的pH>8,则溶液中c(H2CO3)>c(CO32-)(填“>”、“=”或“<”).
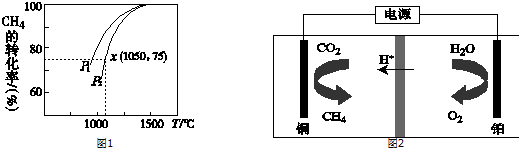
(2)有机物加氢反应中镍是常用的催化剂.但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,查得资料如图1:
则:SO2(g)+2CO(g)=S(s)+2CO2(g)△H=-270kJ/mol.
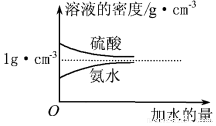
(3)已知N2(g)+3H2(g)?2NH3(g)△H=-94.4kJ•mol-1,恒容时,体系中各物质浓度随时间变化的曲线如图2所示,各时间段最终均达平衡状态.
①在2L容器中发生反应,时段Ⅰ放出的热量为94.4kJ.
②25min时采取的某种措施是将NH3从反应体系中分离出去.
③时段Ⅲ条件下反应的平衡常数为2.37.(保留3位有数字)
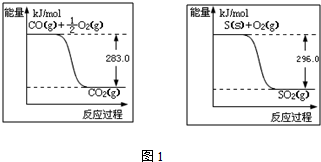
(4)电化学降解N的原理如图3所示.电源正极为A(填“A”或“B”),阴极反应式为2NO3-+12H++10e-=N2↑+6H2O.
分析 (1)反应物中的原子全部参加反应的,原子利用律最高,据此解答即可;水电离的OH-的物质的量浓度=$\frac{1{0}^{-14}}{1{0}^{-PH}}$;常温下,0.1mol•L-1 KHCO3溶液pH>8,说明碳酸氢根在水解程度大于电离程度;
(2)由图1可知,O2(g)+2CO(g)=2CO2(g)△H=(-2×283)kJ•mol-1=-566kJ•mol-1,(i)
S(s)+O2(g)=SO2(g)△H=-296kJ•mol-1,(ii)
利用盖斯定律(i)-(ii)计算即可;
(3)①根据时段Ⅰ达到平衡时生成氨气的物质的量及热化学方程式N2(g)+3H2(g)?2NH3(g);△H=-94.4kJ•mol-1计算出放出的热量;
②根据25min时氨气的物质的量变为0,而氮气和氢气的物质的量不变进行解答,改变的条件是分离出氨气;
③根据时段Ⅲ条件下达到平衡时各组分的浓度及平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积进行解答;
(4)由图示知在Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,则B为负极,A为电源正极;在阴极反应是NO3-得电子发生还原反应生成N2,利用电荷守恒与原子守恒知有氢离子参与反应且有水生成.
解答 解:(1)观察四个反应方程式可见,只有反应d中参加反应的物质全部转化为一种物质,故原子利用率最高;
可用碳酸钾溶液吸收生成的CO2,常温下pH=10的碳酸钾溶液中水电离的c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-PH}}$mol/L=1×10-4 mol•L-1;
常温下,0.1mol•L-1 KHCO3溶液pH>8,则溶液中碳酸氢根离子水解程度大于电离程度,所以c(H2CO3)>c(CO32-);
故答案为:d; 1×10-4 mol•L-1;>;
(2)由图1可知,O2(g)+2CO(g)=2CO2(g)△H=(-2×283)kJ•mol-1=-566kJ•mol-1,(i)
S(s)+O2(g)=SO2(g)△H=-296kJ•mol-1,(ii)
(i)-(ii)得:SO2(g)+2CO(g)=S(s)+2CO2(g)△H=-563-(-298)=-270kJ•mol-1,
故答案为:-270kJ/mol;
(3)①时段Ⅰ达到平衡时生成的氨气的物质的量为:1.00 mol/L×2L=2.00mol,
根据N2(g)+3H2(g)?2NH3(g);△H=-94.4kJ•mol-1可知生成2.00mol氨气放出的热量为94.4kJ,
故答案为:94.4kJ;
②25min时氨气的物质的量迅速变为0而氮气、氢气的物质的量不变,之后氮气、氢气的物质的量逐渐减小,氨气的物质的量逐渐增大,说明25min时改变的条件是将NH3从反应体系中分离出去,
故答案为:将NH3从反应体系中分离出去;
③时段Ⅲ条件下,反应为:N2(g)+3H2(g)?2NH3(g),图象方向可知平衡状态下[N2]=0.25mol/L,[NH3]=0.50mol/L,[H2]=0.75mol/L,该反应的化学平衡常数为:K=$\frac{{c}^{2}(N{H}_{3})}{{c({N}_{2})c}^{3}({H}_{2})}$=$\frac{(0.50mol/L)^{2}}{(0.75mol/L)^{3}×0.25mol/L}$=2.37,
故答案为:2.37;
(4)由图示知在Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,则B为负极,A为电源正极;在阴极反应是NO3-得电子发生还原反应生成N2,利用电荷守恒与原子守恒知有H2O参与反应且有水生成,
所以阴极上发生的电极反应式为:2NO3-+12H++10e-=N2↑+6H2O,
故答案为:A,2NO3-+12H++10e-=N2↑+6H2O.
点评 本题主要考查的是绿色化学的概念、盖斯定律的应用、影响化学平衡的因素及电解池工作原理,题目难度中等,明确化学平衡常数的概念及计算方法是解题关键.

 无机化合物可根据其组成和性质进行分类
无机化合物可根据其组成和性质进行分类(1)如图所示的物质分类方法的名称是树状分类法.
(2)以Na、K、H、O、S、N中任两种或三种元素组成合适的物质,分别填在下表中②③⑥后面.
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①HCl②H2SO4 | ③NaOH ④Ba(OH)2 | ⑤Na2CO3 ⑥K2SO4 | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
(4)写出实验室由⑩制备O2的化学方程式:2H2O2$\frac{\underline{\;二氧化锰\;}}{\;}$2H2O+O2↑.
(5)写出③与⑦反应的离子方程式2OH-+CO2=CO32-+H2O
(6)反应Cu+4HNO3(稀)═Cu(NO3)2+2NO2↑+2H2O中,用用单线桥法表示电子得失的方向和数目:
硝酸氧化剂:还原剂铜;若消耗19.2g Cu,则被还原HNO3是0.6mol,转移0.6NA个电子.
| A. | 该元素为Mn元素 | B. | 该元素最高化合价为+7 | ||
| C. | 该元素属于d区元素 | D. | 该元素原子最外层共有7个电子 |
(1)工业上一般采用CO和H2反应合成可再生能源甲醇.反应如下:CO(g)+2H2(g)?CH3OH(g)△H=-90.1KJ•mol-1在250℃下,将一定量的CO和H2投入10L的密闭容器中,各物质的物质的量浓度(mol•L-1)变化如表所示:(前6min没有改变条件)
| 2min | 4min | 6nin | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.20 | … |
| CH2OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
②250℃时该反应的平衡常数K的计算式为:$\frac{0.04}{0.06×0.1{2}^{2}}$ (不必化简).
③若6min~8min只改变了某一条件,所改变的具体条件是加1 mol氢气.
④第8min时,该反应是不是达到平衡状态不是.(填“是”或“不是”)
(2)某硝酸厂处理尾气中的NO的方法是用H2将NO还原为N2.已知:

H2还原NO生成氮气和水蒸气的热化学方程式是2NO(g)+2H2(g)═N2(g)+2H2O(g)△H=-665 kJ•mol-1.
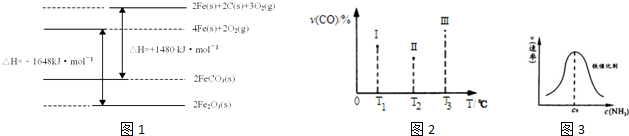
 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用图表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用图表示:

 .
.