题目内容
17.物质结构的多样性让人类使用的材料精彩纷呈.
(1)如图1是原子序数相连的七种短周期元素第一电离能示意图.其中硼(B)和氧(O)元素分别是⑤、③(填图中元素代号).
(2)PCl6-和SF6呈正八面体的结构(分别如图2、3),PCl6-阴离子中是(填“是”或“否”)存在配位键,原因是P原子只有5个价电子,但在该离子中P原子形成了6个共价键,必有一个配位键;
如果SF6中的若干个F原子被Cl原子取代形成SFxCl6-x (x不为0),则SFxCl6-x不同分子种数为C.
A.6种 B.7种 C.9种 D.12种
(3)Mn、Fe均为第四周期过渡元素,两元素的部分电离能(I)数据列于如表:
| 元素 | Mn | Fe | |
| 电离能(KJ•mol-1) | Ⅰ1 | 717 | 759 |
| Ⅰ2 | 1509 | 1561 | |
| Ⅰ3 | 3248 | 2957 | |
Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物,六氰合铁(Ⅲ)离子[Fe(CN)6]3- 中的配体CN- 中C原子的杂化轨道类型是sp,写出一种与CN- 互为等电子体的单质分子的结构式N≡N.
分析 (1)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第ⅡA元素第一电离能大于第ⅢA元素,第ⅤA族的第一电离能大于第ⅥA族元素;
(2)P原子只有5个价电子,PCl6-呈正八面体的结构,P原子形成了6个共价键,有一个配位键;根据SF6中的将一个F、两个F、三个F、四个F、五个F、六个F等依次被氯取代,据此判断分子种数;
(3)原子轨道中电子处于全满、全空、半满时最稳定;根据价层电子对互斥理论确定杂化方式;原子个数相等价电子数相等的微粒为等电子体.
解答 解:(1)根据图片知,同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第ⅡA元素第一电离能大于第ⅢA元素,第ⅤA族的第一电离能大于第ⅥA族元素,所以硼B元素是⑤,②为氮元素,③为氧元素,
故答案为:⑤、③;
(2)P原子的原子序数为15,基态氮原子的价电子排布式是1s22s22p63s23p3,只有5个价电子,但在该离子中P原子形成了6个共价键,必有一个配位键,
在SF6中的将一个F被氯原子取代有一种,两个F原子被取代有2种(相邻和相对),三个F被取代有2种(共平面、共体面),四个F被取代、五个F被取代对应二取代、一取代的结构种数相同,分别为2种、1种,别外全取代有1种,所以共有9种,故选:C,
故答案为:是;P原子只有5个价电子,但在该离子中P原子形成了6个共价键,必有一个配位键;C;
(3)原子轨道中电子处于全满、全空、半满时最稳定,Mn2+的3d轨道电子排布为半满状态较稳定,CN-中C原子与N原子键以三键连接,三键中有1个δ键、2个π键,C原子还有一对孤对电子,杂化轨道数2,C原子采取sp杂化.CN-含有2个原子,价电子总数为4+5+1=10,故其等电子体为氮气分子等,结构式为N≡N,
故答案为:Mn2+的3d轨道电子排布为半满状态较稳定;sp;N≡N.
点评 本题通过考查SF6的分子结构实际上是考查了同分异构现象、杂化轨道类型的判断、等电子体等知识,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 简单离子半径的大小顺序:r(W)>r(Y)>r(Z) | |
| B. | 元素Z、W 的简单离子的电子层结构不同 | |
| C. | 元素Y 的简单气态氢化物的热稳定性比Z 的强 | |
| D. | W、Y、Z 三种元素的氢化物中,W的熔点最高 |
(1)上述方程式中涉及到的N、O元素电负性由小到大的顺序是N<O.
(2)基态S的价电子排布式为3s23p4.与Cu同周期且最外层电子数相等的元素还有K、Cr(填元素符号).
(3)PO43-的空间构型是正四面体,其中P原子的杂化方式为sp3.
(4)在硫酸铜溶液中加入过量KCN溶液,生成配合物[Cu(CN)4]2-,则1molCN-中含有的π键数目为2NA.
(5)铜晶体为面心立方最密集堆积,铜的原子半径为127.8pm,列式计算晶体铜的密度9.0g/cm3.
(6)表中列出了含氧酸酸性强弱与非羟基氧原子数的关系.
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 | Cl-OH | 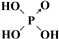 | 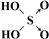 | 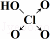 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 .亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O.
.亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O. | A. | 该合金中铁的质量为5.6g | |
| B. | 合金与稀硫酸反应共生成0.45mol H2 | |
| C. | 该合金与足量氢氧化钠反应,转移的电子数为0.6NA | |
| D. | 所加的稀硫酸中含0.6molH2SO4 |
| A. | NH4HCO3溶于过量的浓KOH溶液中:NH4++HCO3-+2OH-═CO32-+NH3↑+2H2O | |
| B. | 双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-═I2+2H2O | |
| C. | 向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O |
| A. | 44.5kJ/mol | B. | 1364.7kJ/mol | C. | 2729.3kJ/mol | D. | 89.0kJ/mol |
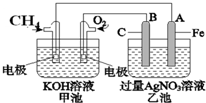 如图是一个电化学过程的示意图.已知甲池的总反应式为
如图是一个电化学过程的示意图.已知甲池的总反应式为