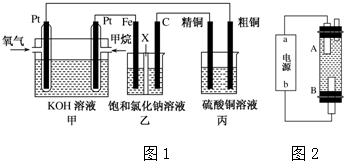
题目内容
10.无水FeCl3是一种重要的化学试剂,其熔点306℃沸点315℃,遇潮湿空气即产生大量白雾.某中学化学兴趣小组拟利用中学常见仪器设计实验制备无水FeCl3,实验装置如图所示.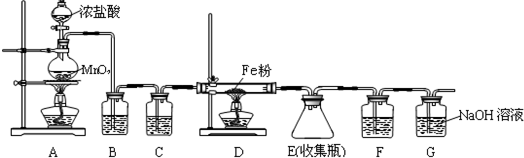
请回答下列问题:
(1)制备实验开始时,先检查装置的气密性,检查装置A的气密性的方法是将止水夹夹于E装置后的橡胶管上,在分液漏斗中加入水,打开分液漏斗的瓶塞和下端活塞,若无持续水滴滴下,则气密性良好.
(2)装置A中发生反应的离子方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,其中被还原的物质是MnO2.
(3)写出D装置中可能观察到的现象是看到棕黄色的烟产生.
(4)装置B和F中的试剂分别是饱和食盐水、浓硫酸.
(5)甲同学认为F和G可以用一种仪器替代,且加入一种药品即可达到相同效果.这种药品可以是碱石灰或氧化钙.
(6)为检验D中的产物是否部分进入到F集气瓶中,可采用进行如下实验:取F中溶液少许,加入适量蒸馏水稀释,然后向溶液中滴加(写名称)硫氰化钾溶液,若观察到(现象)溶液中出现血红色则说明含有D中的生成物.该反应的离子方程式为Fe3++3SCN-=Fe(SCN)3.
分析 根据实验装置图可知,该实验中用浓盐酸与MnO2反应生成Cl2,浓盐酸具有挥发性,加热时水挥发,所以制取的Cl2中有HCl、H2O等杂质,HCl极易溶于水,Cl2不易溶于水饱和食盐水,所以先用饱和食盐水除HCl,为防止氯化铁水解,所以再用浓硫酸干燥,Cl2与Fe反应制得FeCl3,反应的尾气中有Cl2用NaOH吸收,为防止FeCl3与NaOH溶液中的水蒸气反应,所以在收集装置和尾气吸收装置之间加一干燥装置,据此答题;
(1)利用压强差看分液漏斗中的液体能否滴下检查装置的气密性;
(2)加热条件下,浓盐酸和二氧化锰的反应生成氯化锰、氯气和水,根据化合价的变化判断被还原的物质;
(3)D中为铁粉与氯气反应生成氯化铁,氯化铁的沸点较低,所以加热之后可以看到棕黄色的烟;
(4)装置B是除去氯化氢气体,装置C是干燥气体;
(5)根据所给的装置图可知,因为氯化铝易发生水解,故应该防止空气中的水蒸气进入E装置,而G是吸收空气中的CO2,所以可以加入碱石灰或氧化钙来代替F和G的作用;
(6)D中的产物为氯化铁,可以用硫氰化钾溶液检验铁离子,以判断F中有没有铁离子;
解答 解:(1)检查气密性的操作方法为将止水夹夹于E装置后的橡胶管上,在分液漏斗中加入水,打开分液漏斗的瓶塞和下端活塞,若无持续水滴滴下,则气密性良好,
故答案为:将止水夹夹于E装置后的橡胶管上,在分液漏斗中加入水,打开分液漏斗的瓶塞和下端活塞,若无持续水滴滴下,则气密性良好;
(2)加热条件下,浓盐酸和二氧化锰的反应生成氯化锰、氯气和水,反应方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,在该反应中锰元素的化合价降低,所以MnO2被还原,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;MnO2;
(3)D中为铁粉与氯气反应生成氯化铁,氯化铁的沸点较低,所以加热之后可以看到棕黄色的烟,
故答案为:看到棕黄色的烟产生;
(4)浓盐酸具有挥发性,加热促进浓盐酸挥发,水易挥发,所以生成的氯气中含有HCl和H2O,为防止HCl和H2O影响实验,所以要除去H2O,先用饱和食盐水除去HCl,再用浓硫酸干燥气体,则装置B是除去氯化氢气体,装置C是干燥气体,
故答案为:饱和食盐水;浓硫酸;
(5)根据所给的装置图可知,因为氯化铝易发生水解,故应该防止空气中的水蒸气进入E装置,而G是吸收空气中的CO2,所以可以加入碱石灰或氧化钙来代替F和G的作用,
故答案为:碱石灰或氧化钙;
(6)D中的产物为氯化铁,可以用硫氰化钾溶液检验铁离子,若溶液中出现血红色,则说明溶液中含有铁离子,反应的离子方程式为Fe3++3SCN-=Fe(SCN)3,
故答案为:硫氰化钾溶液;溶液中出现血红色;Fe3++3SCN-=Fe(SCN)3.
点评 本题考查物质制备,为高频考点,侧重于学生的分析能力和实验能力的考查,明确实验原理、实验基本操作是解本题关键,注意各个装置作用及可能发生的反应,题目难度中等.

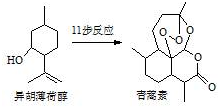 2015年我国药物化学家屠吆吆因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为起始原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )
2015年我国药物化学家屠吆吆因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为起始原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )| A. | 异胡薄荷醇遇FeCl3溶液显紫色 | |
| B. | 异胡薄荷醇可发生消去反应、加成反应 | |
| C. | 青蒿素分子中含有5个手性碳原子 | |
| D. | 青蒿素在热的酸、碱溶液中均可稳定存在 |
| A. | 有机物 属于芳香烃,含有两种官能团 属于芳香烃,含有两种官能团 | |
| B. | 按系统命名法,化合物 的名称为2,3,6三甲基5乙基庚烷 的名称为2,3,6三甲基5乙基庚烷 | |
| C. |  既属于醇类又属于羧酸 既属于醇类又属于羧酸 | |
| D. | 2甲基3丁烯的命名错误原因是选错了主链 |
| A. | 标准状况下,22.4 LH2O含有NA个水分子 | |
| B. | 标准状况下,22.L空气含有NA个单质分子 | |
| C. | 常温常压下,11.2 L氯气所含的原子数目为NA | |
| D. | 标准状况下,1.12 L O2 和1.12 L CO2均含有0.1NA氧原子 |
①醋酸钠固体 ②Na2CO3晶体 ③氯化钠溶液 ④铁粉 ⑤浓盐酸 ⑥NaOH晶体.
| A. | ①③④ | B. | ①③ | C. | ②④⑥ | D. | ②⑤⑥ |
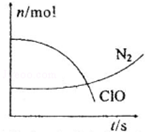
| A. | 还原剂是含CN-的物质,氧化产物不只有N2 | |
| B. | 氧化剂是ClO-,还原产物是HCO3- | |
| C. | 参与反应的氧化剂与还原剂的物质的量之比为5:2 | |
| D. | 标准状况下若生成2.24LN2则转移电子1mol |
 如图,烧杯中盛有等体积的水和煤油,现将一小块金属钠加入烧杯中,试推断能观察到的实验现象应是( )
如图,烧杯中盛有等体积的水和煤油,现将一小块金属钠加入烧杯中,试推断能观察到的实验现象应是( )| A. | 钠悬浮在煤油层中 | |
| B. | 钠静止在两液面之间 | |
| C. | 钠沉入水底下 | |
| D. | 钠熔化成闪亮的小球,在两液体界面附近上下跳动 |
I.标准液的配制
(1)所需的实验仪器有烧杯、量筒、玻璃棒,还缺少的玻璃仪器是500mL容量瓶和胶头滴管.
(2)称量所需高锰酸钾固体7.9g,用少量蒸馏水溶解于烧杯中,搅拌,待冷却至室温,转移至容量瓶中,并用50mL蒸馏水洗涤烧杯2~3次,洗涤液也要注入容量中,并摇匀.
(3)若定容时,俯视观察液面,造成所配高锰酸钾溶液浓度偏高(填“偏高”、“偏低”、“不影响”).
II.滴定工业废水中铁元素的含量(全部铁元素以Fe2+形式存在).
(4)在滴定时,每次准确量取待测液25.00ml于锥形瓶中,并加入适量酸酸化后进行滴定,你认为可以加入下面哪种酸C
A.盐酸 B.硝酸 C.硫酸
(5)已知亚铁离子与高锰酸根按照物质的量之比5:1反应,写出酸性条件下滴定反应的离子方程式5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O.
(6)重复三次滴定,结果记录如下表:计算该工业废水中亚铁离子的浓度为0.2mol/L
| 实验序号 | 高锰酸钾溶液体积(ml) | 废水样品的体积(ml) |
| 1 | 10.02 | 25.00 |
| 2 | 10.62 | 25.00 |
| 3 | 9.98 | 25.00 |