题目内容
2.如图1所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.请按要求回答相关问题: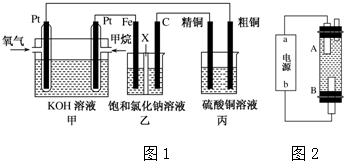
(1)甲烷燃料电池正极反应式是O2+2H2O+2e-═4OH-.
(2)乙池Fe电极的电极反应式为2H2O+2e-═H2+2OH-.
(3)若在标准状况下,有1.68LCH4参加反应,则乙装置中石墨(C)极上生成的气体体积为6.72L;丙装置中阴极析出铜的质量为19.2g.
(4)某同学利用甲烷燃料电池设计电解法制取漂白液的实验装置(如图2所示).则a为电池的负极,电解质溶液最好用饱和食盐水.
分析 燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极.
(1)燃料电池中,负极上投放燃料,负极上失电子发生氧化反应.
(2)甲中投放氧化剂的电极是正极,所以乙装置中石墨是阳极,阳极上氯离子失电子发生氧化反应.
(3)根据串联电池中转移电子数相等计算石墨电极产生氯气的体积、丙装置中析出铜的质量.
(4)电解饱和食盐水时,阴极上析出氢气,阳极上析出氯气,氯气和氢氧化钠反应生成次氯酸钠,次氯酸钠是漂白液的有效成分.
解答 解:(1)燃料电池中,负极上投放燃料所以投放甲烷的电极是负极,负极上失电子发生氧化反应,电极反应式为:CH4+10OH--8e-=CO32-+7H2O,正极上是氧气得电子的还原反应,电极反应式为:O2+2H2O+2e-═4OH-.
故答案为:O2+2H2O+2e-═4OH-.
(2)甲中投放氧化剂的电极是正极,所以乙装置中石墨电极是阳极,Fe电极是阴极,阳极上氯离子失电子发生氧化反应,电极反应式为:2Cl--2e-=Cl2↑,阴极上发生得电子的还原反应,即2H2O+2e-═H2↑+2OH-,
故答案为:2H2O+2e-═H2+2OH-;
(3)串联电池中转移电子数相等,若在标准状况下,有1.68L即0.075molCH4参加反应,根据:CH4+10OH--8e-=CO32-+7H2O,则转移电子的物质的量=0.075mol×8=0.6mol,乙装置中石墨电极生成氯气,设生成氯气的体积为xL;丙装置中阴极上析出铜,设析出铜的质量为yg.
2Cl--2e-=Cl2↑
2 1
0.6mol xL
x=0.3mol,产生氯气的体积是0.3mol×22.4L/mol=6.72L,
2Cu 2++2e-=Cu
2mol 64g
0.6mol yg
y=19.2g
故答案为:6.72;19.2.
(4)电解饱和食盐水时,阴极上析出氢气,阳极上析出氯气,氯气和氢氧化钠反应生成次氯酸钠,次氯酸钠是漂白液的有效成分,B电极上生成氯气,氯气的密度小于溶液的密度,所以生成的氯气上升,能和氢氧化钠溶液充分的接反应生成次氯酸钠,所以A极上析出氢气,即A极是阴极,所以a为电池负极,用饱和氯化钠溶液或食盐水做电解质溶液,
故答案为:负极;饱和食盐水.
点评 本题考查了原电池和电解池原理及物质的量的有关计算,难点是(4)题中电解质溶液的选取及电极材料的选取,根据实验目的进行正确选取即可.

| A. | 2.24 L CO2中含有原子数为0.3NA | |
| B. | 25℃,pH=13的NaOH溶液中含有OH-为0.1NA | |
| C. | 一定条件下,4.6 g NO2和N2O4混合气体中含有的N原子数目为0.1NA | |
| D. | 1L0.1molL-1的氨水中有NA个NH4+ |
| A. | 60乙醇中存在的共价键总数为10NA | |
| B. | 1L 0.1mol•L-1的NaHCO3溶液中HO3-和CO32-E离子数之和为0.1NA | |
| C. | 钠在空气中燃烧可生成多种氧化物.23g钠充分燃烧时转移电子数为1NA | |
| D. | 同温、同压、同体积的CO和NO含有的质子数 |
有关数据如表:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
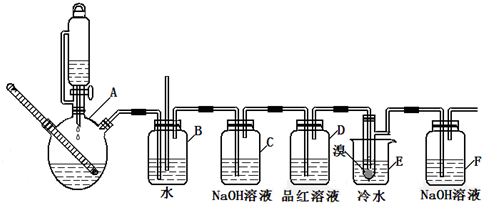
(1)A中药品为1:3的无水乙醇和浓硫酸混合液,写出制备乙烯的化学反应方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(2)下列有关A中反应说法错误的是AD(填编号)
A.将乙醇缓慢加入浓硫酸中配制混合酸
B.温度在140℃时,其主要反应为取代反应
C.浓硫酸的作用是脱水和催化
D.加入碎瓷片的作用是加快反应速度
(3)装置D中品红溶液的作用是验证二氧化硫是否被除尽;同时B装置是安全瓶,监测实验进行时E中是否发生堵塞,请写出堵塞时的现象玻璃管中液面上升.
(4)反应过程中应用冷水冷却装置E,其主要目的是减少液溴挥发,但又不能用冰水,其原因是1,2-二溴乙烷易凝结成固体而发生堵塞.
(5)装置F中的化学反应方程式为:Br2+2NaOH=NaBr+NaBrO+H2O.