题目内容
9.下列化学式及结构式中,从成键情况看不合理的是( )| A. |  | B. |  | ||
| C. |  | D. |  |
分析 根据每种元素形成的化学键判断正误,氮原子能形成3个共价键,碳原子能形成4个共价键,硫原子能形成2个共价键,氢原子能形成1个共价键,氧原子能形成2个共价键.
解答 解:A.该分子中每个氢原子能形成1个共价键,氮原子能形成3个共价键,碳原子能形成4个共价键,成键合理,故A不选;
B.该分子中碳原子能形成4个共价键,硫原子能形成2个共价键,氢原子能形成1个共价键,成键情况合理,故B不选;
C.该分子中每个碳原子能形成4个共价键,氢原子能形成1个共价键,氧原子能形成2个共价键,硫原子能形成2个共价键,从而使各个原子能达到稳定结构,故C不选;
D.C、Si原子能形成4个共价键,成键情况不合理,故D选;
故选:D.
点评 本题考查了化学键的判断,明确每个原子价层电子数是解本题关键,难度不大.

练习册系列答案
相关题目
19.下列不能通过单质间反应而制得的物质是( )
| A. | CuCl2 | B. | CuO | C. | FeCl2 | D. | HCl |
17.X、Y、Z、M、N是原子序数依次增大的短周期主族元素,其中X与Z为同族元素,Y和M为同族元素,且Y与M的核外电子数之和为X和Z元素的核外电子数之和的2倍,下列说法正确的是( )
| A. | 原子半径:Z>M>N>X>Y | B. | M与N形成的化合物中N显正价 | ||
| C. | 单质沸点:Z>M>N>Y>X | D. | 最高正价:N>M=Y>Z=X |
4.按照物质不同的分类方法,HNO3应属于( )
①酸 ②氢化物 ③氧化物 ④含氧酸 ⑤难挥发性酸⑥混合物 ⑦一元酸 ⑧化合物.
①酸 ②氢化物 ③氧化物 ④含氧酸 ⑤难挥发性酸⑥混合物 ⑦一元酸 ⑧化合物.
| A. | ①②③④⑤⑦⑧ | B. | ①④⑦⑧ | C. | ①⑥ | D. | ①④⑤⑦⑧ |
14.某元素R的氯化物溶液10mL,其浓度为0.05mol/L,能恰好与0.1mol/L的 AgNO3溶液15mL完全反应,则R氯化物的化学式为( )
| A. | RCl | B. | RCl2 | C. | RCl3 | D. | RCl4 |
4.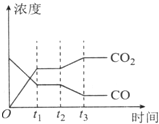 节能减排是当下环境保护的重点.
节能减排是当下环境保护的重点.
(1)将C0和气态水通人一个体积固定的密闭容器中,在一定条件下发生如下可逆反应:CO(g)+H20(g)=C02(g)+H2(g)△H<0
800℃,在2L恒容密闭容器中,起始时按照下表数据进行投料,达到平衡状态,K=1.0
①从起始经过5min达到化学平衡时,用生成物C02表示该反应的反应速率v(C02):0.01mol/(L•min)平衡时,容器中C0的转化率为50%
②如图表示上述反应在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况.则t2时刻发生改变的条件可能是降低温度或降低H2浓度或增大H2O(g)浓度(写出一条).
(2)汽车尾气中的一氧化碳是大气污染物,可通过反应:CO(g)+$\frac{1}{2}$02(g)?O2(g)降低其浓度.
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如表所示.请在表中的空格处填写“>”“<”或“=”
②相同温度下,某汽车尾气中C0、C02的浓度分别为1.0X 10-5mol/L和1.0×10-4mol/L.若在汽车的排气管上增加一个补燃器,不断补充02并使其浓度保持为1.0X10-4 mol/L,则最终尾气中CO的浓度为1.1×10-6mol/L(请保留两位有效数字).
(3)CO2在自然界循环时可与CaC03反应,CaC03是一种难溶物质,其Ksp=2.8×10-9.现将等体积的CaCl2溶液与Na2C03溶液混合,若Na2C03溶液的浓度为2×10-4mol/L,则生成 CaC03沉淀所需原CaCl2溶液的最小浓度为5.6×10-5 mol/L.
 节能减排是当下环境保护的重点.
节能减排是当下环境保护的重点.(1)将C0和气态水通人一个体积固定的密闭容器中,在一定条件下发生如下可逆反应:CO(g)+H20(g)=C02(g)+H2(g)△H<0
800℃,在2L恒容密闭容器中,起始时按照下表数据进行投料,达到平衡状态,K=1.0
| H2O | CO | C02 | H2 | |
| n/mol | 0.20 | 0.20 | 0 | 0 |
②如图表示上述反应在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况.则t2时刻发生改变的条件可能是降低温度或降低H2浓度或增大H2O(g)浓度(写出一条).
(2)汽车尾气中的一氧化碳是大气污染物,可通过反应:CO(g)+$\frac{1}{2}$02(g)?O2(g)降低其浓度.
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如表所示.请在表中的空格处填写“>”“<”或“=”
| 容器编号 | c(CO)/mol•L-1 | c(02)/mol•L-1 | c(C02)/mol•L-1 | V(正)和v(逆)比较 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | V(正)=v(逆 |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | V(正)> v(逆 |
(3)CO2在自然界循环时可与CaC03反应,CaC03是一种难溶物质,其Ksp=2.8×10-9.现将等体积的CaCl2溶液与Na2C03溶液混合,若Na2C03溶液的浓度为2×10-4mol/L,则生成 CaC03沉淀所需原CaCl2溶液的最小浓度为5.6×10-5 mol/L.
 氯化硫酰(SO2Cl2)主要用作氯化剂.它是一种无色液体,熔点-54.1℃,沸点69.1℃.氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:
氯化硫酰(SO2Cl2)主要用作氯化剂.它是一种无色液体,熔点-54.1℃,沸点69.1℃.氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:
 .
.