题目内容
4.按照物质不同的分类方法,HNO3应属于( )①酸 ②氢化物 ③氧化物 ④含氧酸 ⑤难挥发性酸⑥混合物 ⑦一元酸 ⑧化合物.
| A. | ①②③④⑤⑦⑧ | B. | ①④⑦⑧ | C. | ①⑥ | D. | ①④⑤⑦⑧ |
分析 HNO3在水中电离出的阳离子只有氢离子属于酸;硝酸中含有氧元素,所以属于含氧酸;硝酸是由氢、氧、氮元素组成的纯净物,属于化合物不是氢化物;硝酸在水溶液中能能电离出一个氢离子,根据物质的分类知识回答.
解答 解:HNO3在水中电离出的阳离子只有氢离子属于酸;硝酸中含有氧元素,所以属于含氧酸;硝酸是由氢、氧、氮元素组成的纯净物,属于化合物,不是氢化物;硝酸在水溶液中能电离出一个氢离子,属于一元酸,易挥发,属于挥发性的酸,
故选:B.
点评 本题主要考查物质的分类方法,解答时要分析物质的元素组成和物质组成,然后再根据各类物质概念的含义进行分析、判断,从而得出正确的结论.

练习册系列答案
相关题目
14.若1g CO2中含有x个原子,则阿伏加德罗常数可表示为( )
| A. | $\frac{1}{44}$ mol-1 | B. | $\frac{x}{22}$ mol-1 | C. | $\frac{3x}{44}$ mol-1 | D. | $\frac{44x}{3}$ mol-1 |
12.下列说法中不正确的是( )
| A. | 电解质不一定能导电 | |
| B. | 氨溶于水得到的氨水能导电,所以氨水是电解质 | |
| C. | 将硫酸钡放入水中不能导电,所以硫酸钡是非电解质 | |
| D. | 在水溶液或熔融状态下能导电的物质叫做电解质 |
9.下列化学式及结构式中,从成键情况看不合理的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
16.铜及其化合物在工农业生产及日常生活中应用非常广泛.
(1)纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
①工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应不易控制,易还原产生Cu.
②已知:2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s)△H=-169kJ•mol-1
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ•mol-1
Cu(s)+$\frac{1}{2}$O2(g)=CuO(s)△H=-157kJ•mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g);△H=+34.5kJ•mol-1.
(2)氢化亚铜是一种红色固体,可由下列反应制备
4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4
该反应每转移3mol电子,生成CuH的物质的量为1mol.
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如图1.
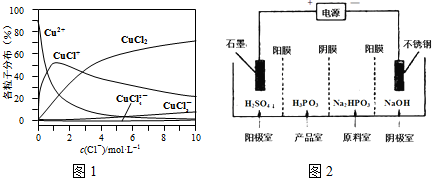
①当c(Cl-)=9mol•L-1时,溶液中主要的3种含铜物种浓度大小关系为c(CuCl2)>c(CuCl+)>c(CuCl3-).
②在c(Cl-)=1mol•L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为CuCl+═Cu2++Cl-(任写一个).
(4)已知:Cu(OH)2是二元弱碱;亚磷酸(H3PO3)是二元弱酸,与NaOH溶液反应,生成Na2HPO3.
①在铜盐溶液中Cu2+发生水解反应的平衡常数为5×10-9;(已知:25℃时,Ksp[Cu(OH)2]=2.0×10-20mol3/L3)
②电解Na2HPO3溶液可得到亚磷酸,装置如2图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过),则产品室中反应的离子方程式为HPO32-+2H+=H3PO3.
(1)纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑. |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
②已知:2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s)△H=-169kJ•mol-1
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ•mol-1
Cu(s)+$\frac{1}{2}$O2(g)=CuO(s)△H=-157kJ•mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g);△H=+34.5kJ•mol-1.
(2)氢化亚铜是一种红色固体,可由下列反应制备
4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4
该反应每转移3mol电子,生成CuH的物质的量为1mol.
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如图1.

①当c(Cl-)=9mol•L-1时,溶液中主要的3种含铜物种浓度大小关系为c(CuCl2)>c(CuCl+)>c(CuCl3-).
②在c(Cl-)=1mol•L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为CuCl+═Cu2++Cl-(任写一个).
(4)已知:Cu(OH)2是二元弱碱;亚磷酸(H3PO3)是二元弱酸,与NaOH溶液反应,生成Na2HPO3.
①在铜盐溶液中Cu2+发生水解反应的平衡常数为5×10-9;(已知:25℃时,Ksp[Cu(OH)2]=2.0×10-20mol3/L3)
②电解Na2HPO3溶液可得到亚磷酸,装置如2图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过),则产品室中反应的离子方程式为HPO32-+2H+=H3PO3.
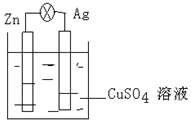 (1)在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,该电极上发生的电极反应式为Zn-2e-=Zn2+,银电极上发生的是还原反应(“氧化”或“还原”).
(1)在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,该电极上发生的电极反应式为Zn-2e-=Zn2+,银电极上发生的是还原反应(“氧化”或“还原”). .
.