题目内容
6.同温同压下,质量忽略不计的两气球A和B,分别充入X气体和Y气体,且充气后两气球的体积相同,若相同条件下,A气球放在CO中静止不动,B气球放在O2中上浮,则下列叙述或表示中正确的是( )| A. | X气体的相对分子质量比Y气体的相对分子质量大 | |
| B. | X可能是C2H4,Y可能是CH4 | |
| C. | X气体的密度小于Y气体的密度 | |
| D. | 充气后A气球质量比B气球质量大 |
分析 A气球放在CO中气球静止不动,说明X气体的密度与CO的密度接近,相对分子质量接近,为28;而B气球放在O2中气球上浮,说明Y气体的密度比氧气的密度小,则Y气体的相对分子质量小于氧气的相对分子质量,即小于32,以此解答该题.
解答 解:A气球放在CO中气球静止不动,说明X气体的密度与CO的密度接近,相对分子质量接近,为28,B气球放在O2中气球上浮,说明Y气体的密度比氧气的密度小,则Y气体的相对分子质量小于氧气的相对分子质量,则:
A.Y气体的相对分子质量小于氧气的相对分子质量,但不能确定与X的相对分子质量的关系,故A错误;
B.A的相对分子质量为28,可能为C2H4,Y气体的相对分子质量小于氧气的相对分子质量,可能为CH4,故B正确;
C.Y气体的密度小于氧气的密度,但不一定比X的大,故C错误;
D.X气体的密度与CO的密度接近,Y气体的密度比氧气的密度小,但二者的密度关系不确定,充气后A气球的质量不一定比B气球的质量大,故D错误.
故选B.
点评 本题考查阿伏加德罗定律及其推论,题目难度中等,注意从密度的大小角度分析,X和Y的关系不能具体确定.

练习册系列答案
相关题目
17.下列反应的离子方程式正确的是( )
| A. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+═Ca2++2H2O | |
| B. | 碳酸钙溶于稀盐酸中 CO32─+2H+═CO2↑+H2O | |
| C. | 碳酸氢钠溶液与盐酸反应 HCO3─+H+═CO2↑+H2O | |
| D. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag |
1.下列有关说法错误的是( )
| A. | 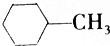 的一氯代物最多有4种 的一氯代物最多有4种 | |
| B. | 乙酸可与乙醇、金属钠、新制Cu(OH)2悬浊液等物质反应 | |
| C. | Cl2可与乙烷发生取代反应,与乙烯发生加成反应 | |
| D. | 阿托酸(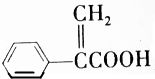 )可用于合成高分子材料 )可用于合成高分子材料 |
8.下列化学用语书写正确的是( )
| A. | 醋酸与NaOH溶液反应的离子方程式为:H++OH-═H2O | |
| B. | 金属钠与乙醇反应的化学方程式为:2Na+2CH3CH2OH→2CH3CH2ONa+H2↑ | |
| C. | 聚氯乙烯的结构简式为: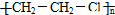 | |
| D. | 氯化铵的电子式为: |
9.下表为元素周期表的一部分.
回答下列问题:
(1)Z元素在周期表中的位置为第三周期,第ⅤⅡA族.
(2)表中元素原子半径最大的是(写元素符号)Si.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac.
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为 .Q与水反应的化学方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑.
.Q与水反应的化学方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑.
(5)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程
式Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol.
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由表中两种元素组成,气体的相对分子质量都小于50.为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L 2.2mol/LNaOH溶液和1molO2,则两种气体的分子式及物质的量分别为NO 0.9mol,NO2 1.3mol,生成硫酸铜物质的量为2mol.
| 碳 | 氮 | Y | |
| X | 硫 | Z |
(1)Z元素在周期表中的位置为第三周期,第ⅤⅡA族.
(2)表中元素原子半径最大的是(写元素符号)Si.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac.
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为
 .Q与水反应的化学方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑.
.Q与水反应的化学方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑.(5)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程
式Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol.
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由表中两种元素组成,气体的相对分子质量都小于50.为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L 2.2mol/LNaOH溶液和1molO2,则两种气体的分子式及物质的量分别为NO 0.9mol,NO2 1.3mol,生成硫酸铜物质的量为2mol.
