题目内容
19.在CuO和Fe粉的混合物中,加入一定量的稀硫酸,并微热,当反应停止后,滤出不溶物,向滤液中插入一枚铁钉,发现铁钉无任何变化.根据上述现象,确定下面结论正确的是( )| A. | 不溶物只有铜 | |
| B. | 不溶物一定含铜,可能含铁 | |
| C. | 不溶物只有铁 | |
| D. | 溶液中一定含有Fe2+,可能含有Cu2+ |
分析 向滤液中插入一枚铁钉,发现铁钉无任何变化,可判断滤中不含硫酸和硫酸铜,因此所加入的稀硫酸可能恰好完全反应也可能量不足;分析实验过程中可能发生的反应,判断反应后可能得到的物质.
解答 解:A.由于不能确定所加入稀硫酸的量,因此,氧化铜、铁粉都有可能剩余,因此,不溶物不一定全部是Cu,故A错误;
B.根据金属的活动性铁>氢>铜,铁粉能把氧化铜与硫酸反应生成硫酸铜中的铜置换出来,铜不能与硫酸反应,因此,不溶物一定含有Cu;在实验过程中,铁粉可能完全反应也可能出现剩余,因此,不溶物中可能含有铁;故B正确;
C.溶液中没有硫酸铜,则硫酸铜被置换出来,所以固体中一定含有Cu,故C错误;
D.向滤液中插入一枚铁钉,发现铁钉无任何变化,可判断滤中不含硫酸和硫酸铜,故D错误;
故选B.
点评 本题考查了Fe、Cu及其化合物之间的反应,题目难度不大,侧重于基础知识的考查,注意Fe与硫酸、硫酸铜均能反应.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.两种微粒的质子数和电子数都相等,它们不可能是( )
| A. | 一种阳离子和一种阴离子 | B. | 一种单质分子和一种化合物分子 | ||
| C. | 两种原子 | D. | 一种原子和一种分子 |
7.W、X、Y、Z是原子序数依次增大的四种短周期元素,分属于连续的四个主族,电子层数之和为10,四种原子中X原子的半径最大.下列说法正确的是( )
| A. | 四种元素中有两种元素在第二周期 | |
| B. | W所在主族的元素的原子次外层电子数不可能为18 | |
| C. | X、Y、Z的最高价氧化物对应的水化物之间能两两反应 | |
| D. | 工业上获得X、Y单质的方法主要是电解其熔融的氯化物 |
14.下列解释亊实的离子方程式不正碥的是( )
| A. | 用Na2S去除废水中的Hg2+,Hg2++S2-═HgS↓ | |
| B. | 向Fe(NO3)2溶液中滴人稀硫酸.溶液由浅绿色变为黄色3Fe2++4H++NO3-=3Fe2++NO↑+2H2O | |
| C. | 用醋酸、淀粉碘化钾试纸检测加碘食盐中是否有KIO3,IO3-+6I-+6H+=3I2+3H2O | |
| D. | 消毒液的主要成分为NaClO溶液,与洁厨灵混用.产生有毐Cl2,2H+++Cl-+ClO-=Cl2↑+H2O |
4.由沸点数据:甲烷-146℃,乙烷-89℃,丁烷-0.5℃,戊烷36℃,可以判断丙烷的沸点可能是( )
| A. | 高于-0.5℃ | B. | 约是+30℃ | C. | 约是-40℃ | D. | 低于-89℃ |
8.图为元素周期表中短周期的一部分, 四种元素中只有一种是金属,下列说法错误的是( )
四种元素中只有一种是金属,下列说法错误的是( )
 四种元素中只有一种是金属,下列说法错误的是( )
四种元素中只有一种是金属,下列说法错误的是( )| A. | 气态氢化物稳定性:R>Q | |
| B. | 元素T的离子结构示意图为 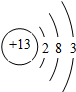 | |
| C. | 与W同主族的某元素形成的18电子的氢化物分子中既有极性键又有非极性键 | |
| D. | Q的一种同位素可用于测定文物的年代 |
9.下列电子式中错误的是( )
| A. | Na+ | B. |  | C. |  | D. |  |
 试回答:
试回答: .
.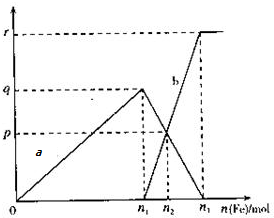 在11.2mol/L的稀硝酸溶液中逐渐加入铁粉,反应中氧化产物的物质的量与加入的铁粉的物质的量的关系如图所示(其中纵坐标为氧化产物的物质的量,横坐标为加入铁粉的物质的量),请回答以下问题:
在11.2mol/L的稀硝酸溶液中逐渐加入铁粉,反应中氧化产物的物质的量与加入的铁粉的物质的量的关系如图所示(其中纵坐标为氧化产物的物质的量,横坐标为加入铁粉的物质的量),请回答以下问题: