题目内容
11.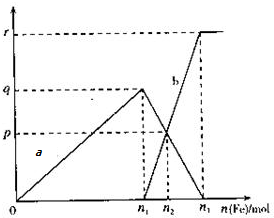 在11.2mol/L的稀硝酸溶液中逐渐加入铁粉,反应中氧化产物的物质的量与加入的铁粉的物质的量的关系如图所示(其中纵坐标为氧化产物的物质的量,横坐标为加入铁粉的物质的量),请回答以下问题:
在11.2mol/L的稀硝酸溶液中逐渐加入铁粉,反应中氧化产物的物质的量与加入的铁粉的物质的量的关系如图所示(其中纵坐标为氧化产物的物质的量,横坐标为加入铁粉的物质的量),请回答以下问题:(1)曲线a代表的氧化产物为Fe(NO3)3(填化学式),生成该产物的离子方程式为Fe+4H++NO3-═Fe3++NO↑+2H2O
(2)曲线b代表的氧化产物对应的离子方程式为Fe+2Fe3+═3Fe2+
(3)n1=q,n2=q+$\frac{q-p}{2}$,
(4)当在点(n2p)时在加入VL 2mol/L的稀硝酸,恰好完全反应,则V为2(n2-n1)L
(5)研究表明硝酸的浓度越小,反应后氮的化合物越低,写出极稀的硝酸溶液加入少量铁粉生成NH4+的离子方程式8Fe+30H++3NO3-═8Fe3++3NH4++9H2O.
分析 向稀硝酸中加入铁粉时,发生两个过程,开始先生成Fe(NO3)3,反应方程式为:Fe+4 HNO3(稀)=Fe(NO3)3+NO↑+2H2O,Fe(NO3)3 与过量的铁继续反应生成 Fe(NO3)2,反应方程式为:2Fe(NO3)3+Fe=3 Fe(NO3)2,由此分析解答.
解答 解:(1)曲线a代表Fe+4 HNO3(稀)=Fe(NO3)3+NO↑+2H2O,反应的氧化产物为Fe(NO3)3,离子方程式为:Fe+4H++NO3-═Fe3++NO↑+2H2O,
故答案为:Fe(NO3)3;Fe+4H++NO3-═Fe3++NO↑+2H2O;
(2)曲线b代表的微粒为亚铁离子,加铁粉从n1到n2发生反应2Fe(NO3)3+Fe=3Fe(NO3)2,反应的离子方程式为:Fe+2Fe3+═3Fe2+;
故答案为:Fe+2Fe3+═3Fe2+;
(3)当Fe为n1mol时,发生反应为Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O,由图可知,Fe(NO3)3为qmol,所以消耗的Fe为qmol,即n1=q;
曲线b代表的微粒为亚铁离子,加铁粉从n1到n2发生反应2Fe(NO3)3+Fe=3 Fe(NO3)2,
即2Fe3+~~~Fe,
2mol 1mol
q-p $\frac{q-p}{2}$
所以n2=n1+$\frac{q-p}{2}$=q+$\frac{q-p}{2}$,
故答案为:q;q+$\frac{q-p}{2}$;
(4)再加入VL2mol/L的稀硝酸,恰好反应完全,说明硝酸与n2-n1 的铁恰好完全反应生成铁离子,而稀硝酸参加氧化还原反应,氧化性的硝酸占整个硝酸的$\frac{1}{2}$,根据得失电子守恒得3(n2-n1)=$\frac{1}{4}$×2×V×3,解之得V=2(n2-n1),
故答案为:2(n2-n1)L;
(5)极稀的硝酸液中加入少量铁粉,生成NH4+的离子方程式为:8Fe+30H++3NO3-═8Fe3++3NH4++9H2O,
故答案为:8Fe+30H++3NO3-═8Fe3++3NH4++9H2O.
点评 本题考查了铁与稀硝酸的反应、有关方程式的水解,题目难度中等,明确图象中各段反应的反应以及曲线代表的物质是解题的关键,侧重于考查学生的分析能力和计算能力.

 学业测评一课一测系列答案
学业测评一课一测系列答案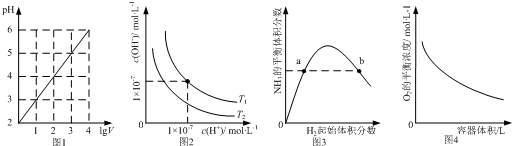
| A. | 图1表示1 LpH=2的CH3COOH溶液加水稀释至V L,pH随lgV的变化 | |
| B. | 图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2>T1 | |
| C. | 图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点 | |
| D. | 图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s)?2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系 |
| A. | v(A)=0.15 mol•L-1•min-1 | B. | v(B)=0.01 mol•L-1•s-1 | ||
| C. | v(C)=0.40 mol•L-1•min-1 | D. | v(D)=0.0075 mol•L-1•s-1 |
| A. | 不溶物只有铜 | |
| B. | 不溶物一定含铜,可能含铁 | |
| C. | 不溶物只有铁 | |
| D. | 溶液中一定含有Fe2+,可能含有Cu2+ |
| A. | 塑料水龙头 | B. | 陶瓷水龙头 | C. | 铜水龙头 | D. | 铁水龙头 |
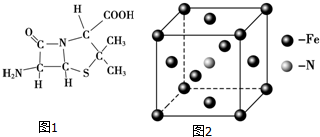
(1)Fe单质为体心立方晶体,晶胞中铁原子的配位数为8,基态铁原子有4个未成对电子,Fe3+的电子排布式为1s22s22p63s23p63d6;.
(2)硝酸钾中NO3-的空间构型为平面正三角形,写出与NO3-互为等电子体的一种非极性分子化学式BF3[SO3(g)、BBr3等].
(3)6氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子有C、N、O、S.
(4)下列说法正确的有a(填字母序号).
a.乙醇分子间可形成氢键,导致其沸点比氯乙烷高
b.钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显-1价
c.聚乙烯(
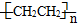 )分子中有5n个σ键
)分子中有5n个σ键d.由下表中数据可确定在反应Si(s)+O2(g)═SiO2(s)中,每生成60g SiO2放出的能量为(2c-a-b) kJ
| 化学键 | Si-Si | O═O | Si-O |
| 键能(kJ•mol-1) | a | b | c |
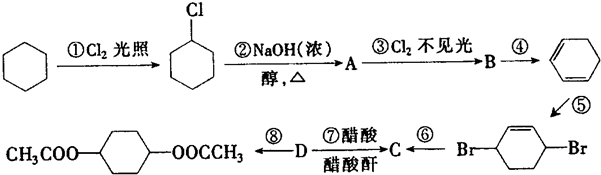
 ,C
,C .
. ③能与水在一定条件下反应生成C
③能与水在一定条件下反应生成C