题目内容
10.某微粒的结构示意图为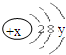 试回答:
试回答:(1)当x-y=10时,该粒子为原子(填“原子”或“阳离子”“阴离子”)
(2)当y=8时,该粒子可能是(任写三种):K+、Cl-、Ar.
(3)写出y=3的元素最高价氧化物与y=6的元素最高价氧化物对应水化物发生反应,反应后所得溶液主要阳离子的结构示意图
 .
.
分析 (1)根据核内质子数与核外电子数是否相等判断粒子的类型;
(2)先根据离子中核内质子数不等于核外电子数,得出离子的核内质子数,依此判断离子种类;
(3)若该粒子为原子,y=3为铝元素时的元素最高价氧化物对应水化物的化学式为Al(OH)3,y=6时为硫元素,元素最高价氧化物对应水化物的化学式为H2SO4.
解答 解:(1)x-y=10时,说明x=10+y,符合核电荷数=质子数=核外电子数,是原子,
故答案为:原子;
(2)原子核电荷数=质子数=核外电子数,原子得失电子可能形成8电子稳定结构,稀有气体是8电子稳定结构;符合结构的原子为Ar,阳离子为K+、Ca2+,阴离子为S2-、Cl-等,
故答案为:K+;Cl-;Ar;
(3)若该粒子为原子,y=3为铝元素时的元素最高价氧化物对应水化物的化学式为Al(OH)3,y=6时为硫元素,元素最高价氧化物对应水化物的化学式为H2SO4,反应后所得溶液主要阳离子为Al3+,结构示意图为 ,故答案为:
,故答案为: .
.
点评 本题考查了原子结构、离子结构的特征分析判断,为高频考点,熟练掌握原子结构的基础知识是解题关键,题目较简单,注意图中各个数字的含义,难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
1.下列图示与对应的叙述相符的是( )

| A. | 图1表示1 LpH=2的CH3COOH溶液加水稀释至V L,pH随lgV的变化 | |
| B. | 图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2>T1 | |
| C. | 图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点 | |
| D. | 图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s)?2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系 |
18.已知几种短周期元素的原子半径、常见的最高价和最低价如下表,下列说法不正确的是( )
| 元素性质 | 元素编号 | ||||||
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | |
| 原子半径(nm) | 0.073 | 0.075 | 0.152 | 0.110 | 0.099 | 0.186 | 0.143 |
| 最高正化合价 | 无 | +5 | +1 | +5 | +7 | +1 | +3 |
| 最低负化合价 | -2 | -3 | 无 | -3 | -1 | 无 | 无 |
| A. | ⑦的简单离子不是同周期元素离子半径最小的 | |
| B. | 气态氢化物的稳定性①>② | |
| C. | 气态氢化物的沸点高低②>④ | |
| D. | 阴离子的还原性④大于⑤,最高价氧化物的水化物的碱性③小于⑥ |
5.若溶液中由水电离产生的c(OH-)=1×10-14 mol•L-1,满足此条件的溶液中一定可以大量共存的离子组是( )
| A. | Al3+ Na+ NO3- Cl- | B. | K+ Na+ Cl- NO3- | ||
| C. | K+ Na+ Cl- CO32- | D. | K+ NH4+ SO42- NO3- |
15.氢有三种同位素:${\;}_{1}^{1}$H、${\;}_{1}^{2}$H和${\;}_{1}^{3}$H,它们之间存在差异的是( )
| A. | 中子数 | B. | 电子数 | C. | 原子序数 | D. | 质子数 |
2.反应A(g)+3B(g)?2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是( )
| A. | v(A)=0.15 mol•L-1•min-1 | B. | v(B)=0.01 mol•L-1•s-1 | ||
| C. | v(C)=0.40 mol•L-1•min-1 | D. | v(D)=0.0075 mol•L-1•s-1 |
19.在CuO和Fe粉的混合物中,加入一定量的稀硫酸,并微热,当反应停止后,滤出不溶物,向滤液中插入一枚铁钉,发现铁钉无任何变化.根据上述现象,确定下面结论正确的是( )
| A. | 不溶物只有铜 | |
| B. | 不溶物一定含铜,可能含铁 | |
| C. | 不溶物只有铁 | |
| D. | 溶液中一定含有Fe2+,可能含有Cu2+ |