题目内容
14.下列解释亊实的离子方程式不正碥的是( )| A. | 用Na2S去除废水中的Hg2+,Hg2++S2-═HgS↓ | |
| B. | 向Fe(NO3)2溶液中滴人稀硫酸.溶液由浅绿色变为黄色3Fe2++4H++NO3-=3Fe2++NO↑+2H2O | |
| C. | 用醋酸、淀粉碘化钾试纸检测加碘食盐中是否有KIO3,IO3-+6I-+6H+=3I2+3H2O | |
| D. | 消毒液的主要成分为NaClO溶液,与洁厨灵混用.产生有毐Cl2,2H+++Cl-+ClO-=Cl2↑+H2O |
分析 A.硫离子与汞离子反应生成硫化汞沉淀;
B.硝酸根在酸性环境下具有强的氧化性,能够氧化二价铁离子生成三价铁离子;
C.醋酸为弱酸应保留化学式,碘原子个数不守恒;
D.次氯酸根离子与氯离子发生归中反应生成氯气;
解答 解:A.用Na2S去除废水中的Hg2+,离子方程式,Hg2++S2-═HgS↓,故A正确;
B.向Fe(NO3)2溶液中滴人稀硫酸.溶液由浅绿色变为黄色,离子方程式:3Fe2++4H++NO3-=3Fe2++NO↑+2H2O,故B正确;
C.用醋酸、淀粉碘化钾试纸检测加碘食盐中是否有KIO3,离子方程式:IO3-+5I-+6CH3COOH=3I2+3H2O+6CH3COO-,故C错误;
D.消毒液的主要成分为NaClO溶液,与洁厨灵混用.产生有毐Cl2,离子方程式:2H+++Cl-+ClO-=Cl2↑+H2O,故D正确;
故选:C.
点评 本题考查了离子方程式的书写,侧重考查氧化还原反应离子方程式书写,明确反应实质及物质的性质是解题关键,注意离子方程式遵循原子个数、电荷数守恒规律,题目难度中等.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
4.下列说法正确的是( )
| A. | 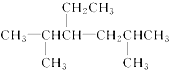 的正确名称是2,5-二甲基-4-乙基己烷 的正确名称是2,5-二甲基-4-乙基己烷 | |
| B. | 胡椒酚的结构简式为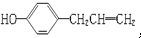 胡椒酚在水中的溶解度小于苯酚在水中的溶解度 胡椒酚在水中的溶解度小于苯酚在水中的溶解度 | |
| C. | 某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n | |
| D. | 2013年11月出现的“夺命快递”--化学品为氟乙酸甲酯,它是一种无色透明液体,不溶于水,易溶于乙醇、乙醚,属于酯类,也属于卤代烃 |
5.若溶液中由水电离产生的c(OH-)=1×10-14 mol•L-1,满足此条件的溶液中一定可以大量共存的离子组是( )
| A. | Al3+ Na+ NO3- Cl- | B. | K+ Na+ Cl- NO3- | ||
| C. | K+ Na+ Cl- CO32- | D. | K+ NH4+ SO42- NO3- |
2.反应A(g)+3B(g)?2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是( )
| A. | v(A)=0.15 mol•L-1•min-1 | B. | v(B)=0.01 mol•L-1•s-1 | ||
| C. | v(C)=0.40 mol•L-1•min-1 | D. | v(D)=0.0075 mol•L-1•s-1 |
9.下列表述正确的是( )
| A. | c(OH-)/c(H+)═10-12的溶液中:NH4+、Cu2+、NO3-、Cl-能大量共存 | |
| B. | 通入过量SO2气体的溶液中:HSO3-、NO3-、Ba2+不能大量共存 | |
| C. | 向足量NaHSO4溶液中逐渐滴入Ba(HCO3)2溶液的离子方程式为:HCO3-+Ba2++H++SO42-═BaSO4↓+H2O+CO2↑ | |
| D. | 向Fe(NO3)3溶液中加入HI溶液的离子方程式为:2Fe3++2I-═2Fe2++2I2 |
19.在CuO和Fe粉的混合物中,加入一定量的稀硫酸,并微热,当反应停止后,滤出不溶物,向滤液中插入一枚铁钉,发现铁钉无任何变化.根据上述现象,确定下面结论正确的是( )
| A. | 不溶物只有铜 | |
| B. | 不溶物一定含铜,可能含铁 | |
| C. | 不溶物只有铁 | |
| D. | 溶液中一定含有Fe2+,可能含有Cu2+ |
3.将自来水管与下列材料做成的水龙头连接,使铁水管锈蚀最快的水龙头是( )
| A. | 塑料水龙头 | B. | 陶瓷水龙头 | C. | 铜水龙头 | D. | 铁水龙头 |
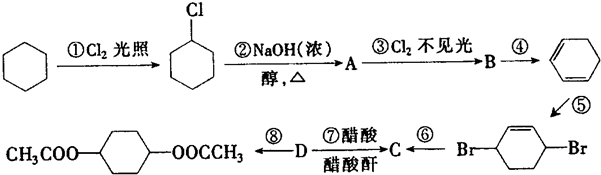
 ,C
,C .
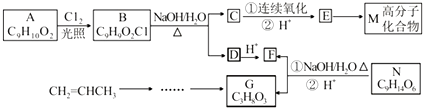
.
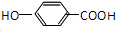 .
. .
.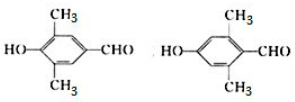 .
.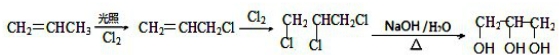 .
.