题目内容
5.有a mol C2H4跟b mol H2在密闭容器中,催化剂存在下反应若干时间后生成了c mol C2H6,除去催化剂后,将此混合气体完全燃烧生成CO2 和H2O,所需氧气的物质的量应是( )| A. | (3a+b) mol | B. | (3a+0.5b-3.5c) mol | ||
| C. | ( 3a+b+3.5c) mol | D. | (3a+0.5b) mol |
分析 无论乙烯和氢气反应程度如何,根据原子守恒,混合物中各元素的原子个数不变,物质的量不变;先计算出碳原子、氢原子的物质的量,然后根据碳氢原子的物质的量求出所需氧气的物质的量.
解答 解:无论乙烯和氢气反应程度如何,根据原子守恒,混合物中各元素的原子个数不变,物质的量不变,碳氢元素的物质的量分别为:
C2H4~2C~4H
1 2 4
amol 2amol 4amol
H2~2H
1 2
bmol 2bmol
所以混合物中n(C)=2amol,n(H)=(4a+2b)mol,混合物完全燃烧时,C转化为CO2、H元素转化为H2O,所以耗氧量=n(C)+$\frac{1}{4}$n(H)=(2a+$\frac{4a+2b}{4}$)mol=(3a+0.5b)mol,
故选D.
点评 本题考查方程式的有关计算,为高频考点,侧重考查学生分析计算能力,明确反应前后存在的原子守恒是解本题关键,注意关系式的灵活运用,题目难度不大.

练习册系列答案
相关题目
16.化学与社会、环境密切相关,下列有关说法正确的是( )
| A. | 蒸馏“地沟油”可以获得汽油 | |
| B. | 明矾水解时产生具有吸附性的胶体粒子,可作漂白剂 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 高纯度的二氧化硅广泛应用于制作光导纤维,光导纤维遇强碱会“断路” |
20.室温时,将xmLPH=a的稀盐酸与ymLPH=b的稀NaOH溶液充分反应,下列关于反应后溶液PH的判断正确的是( )
| A. | 若x=y,且a+b=14,则pH>7 | B. | 若10x=y,且a+b=13,则pH=7 | ||
| C. | 若ax=by,且a+b=14,则pH=7 | D. | 若x=10y,且a+b=14,则pH>7 |
10.制取较纯净的一氯乙烷最好采用的方法是( )
| A. | 乙烷和氯气反应 | B. | 乙烯和氯化氢反应 | ||
| C. | 乙烷通入浓盐酸 | D. | 乙烯和氯气反应 |
17.如表所示是A、B、C、D四种有机物的有关信息:
回答下列问题:
(1)B在50~60℃时,能与混酸(浓硫酸和浓硝酸的混合溶液)反应,其化学方程式为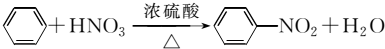
(2)写出C与D反应的化学方程式:CH3COOH+CH3CH218OH CH3CO18OCH2CH3+H2O
CH3CO18OCH2CH3+H2O
(3)写出A与溴的四氯化碳溶液反应的化学方程式:CH2=CH2+Br2→CH2BrCH2Br
(4)C能在铜的作用下与O2反应,写出反应的化学方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
| A | ①能使溴的四氯化碳溶液褪色; ②填充模型为 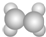 ; ;③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成; ②球棍模型为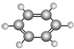 |
| C | ①由C、H、18O三种元素组成,分子中原子个数比为2:6:1;②能与Na反应,但不能 与NaOH溶液反应;③能与D反应生成相对分子质量为90的酯 |
| D | ①由C、H、O三种元素组成; ②球棍模型为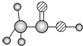 |
(1)B在50~60℃时,能与混酸(浓硫酸和浓硝酸的混合溶液)反应,其化学方程式为

(2)写出C与D反应的化学方程式:CH3COOH+CH3CH218OH
 CH3CO18OCH2CH3+H2O
CH3CO18OCH2CH3+H2O(3)写出A与溴的四氯化碳溶液反应的化学方程式:CH2=CH2+Br2→CH2BrCH2Br
(4)C能在铜的作用下与O2反应,写出反应的化学方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
15.下列离子方程式中书写正确的是( )
| A. | 硫酸与氢氧化钡反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 二氧化碳与足量的氢氧化钠反应:CO2+2OH-═CO32-+H2O | |
| C. | 大理石与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| D. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
 ⑤
⑤
 .
. .
. D.
D. e.
e. …
… 或
或 (只需答出一例的结构简式).
(只需答出一例的结构简式).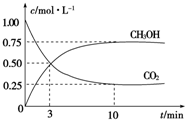 2009年12月7日至18日,气候变化峰会在丹麦首都哥本哈根召开,节能减排成为会议的重要议题.如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g). 测得CO2和CH3OH(g)的浓度随时间变化如图所示.
2009年12月7日至18日,气候变化峰会在丹麦首都哥本哈根召开,节能减排成为会议的重要议题.如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g). 测得CO2和CH3OH(g)的浓度随时间变化如图所示.