题目内容
14.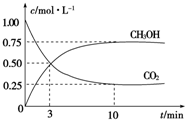 2009年12月7日至18日,气候变化峰会在丹麦首都哥本哈根召开,节能减排成为会议的重要议题.如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g). 测得CO2和CH3OH(g)的浓度随时间变化如图所示.
2009年12月7日至18日,气候变化峰会在丹麦首都哥本哈根召开,节能减排成为会议的重要议题.如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g). 测得CO2和CH3OH(g)的浓度随时间变化如图所示.(1)判断该反应达到平衡的标志是BC
A.CO2和甲醇的浓度相等 B.CO2的百分含量保持不变
C.容器内压强保持不变 D.容器内混合气体的密度保持不变
(2)从反应开始到平衡,氢气的平均反应速率v(H2)=0.225mol/(L•min),二氧化碳的转化率为75%.
分析 (1)可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡;
(2)根据三段式计算出反应混合物各组分的浓度变化量、平衡时的浓度,根据v=$\frac{△c}{△t}$计算出v(H2);根据转化率的定义计算平衡时二氧化碳的转化率.
解答 解:(1)A.CO2和甲醇的浓度相等,而不是不变,故错误;
B.CO2的百分含量保持不变,说明各物质的量不变,反应达平衡状态,故正确;
C.容器内压强不变,说明气体的物质的量不变,故正确;
D.容器内混合气体的密度一直保持不变,故错误;
故答案为:BC;
(2)该工业方法制取甲醇原理为二氧化碳与氢气反应生成甲醇和水,反应方程式为
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
根据三段式计算
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
开始(mol/L):1 3.25 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 1 0.75 0.75
从反应开始到平衡,氢气的平均反应速率v(H2)=$\frac{2.25mol/L}{10min}$=0.225mol/(L.min),平衡时二氧化碳的转化率为$\frac{0.75mol/L}{1mol/L}$×100%=75%,故答案为:0.225;75%.
点评 本题考查化学平衡的有关计算、平衡状态判断,比较基础,有利于基础知识的巩固,注意判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 分子中碳原子不在一条直线上 | B. | 比丁烷更易液化 | ||
| C. | 1mol丙烷完全燃烧需消耗氧气5mol | D. | 光照下能够发生取代反应 |
| A. | (3a+b) mol | B. | (3a+0.5b-3.5c) mol | ||
| C. | ( 3a+b+3.5c) mol | D. | (3a+0.5b) mol |
| A. | 一定互为同分异构体 | B. | 一定互为同系物 | ||
| C. | 实验式一定相同 | D. | 只能是同种物质 |
| A. | 同一元素不可能既有金属性,又有非金属性 | |
| B. | 非金属元素组成的化合物中只含共价键 | |
| C. | 第三周期主族元素的最高化合价等于它所在的主族序数 | |
| D. | 短周期元素形成简单离子后,最外层电子都达到8电子稳定结构 |
| A. | 正、逆反应还在继续进行 | B. | 正、逆反应速率都为零 | ||
| C. | 反应停止 | D. | 正、逆反应速率相等且不为零 |
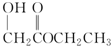
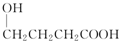
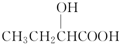
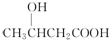

 氯元素的单质及其化合物在生产生活中都很重要.回答下列问题:
氯元素的单质及其化合物在生产生活中都很重要.回答下列问题: .
.