题目内容
 硫、氯及其化合物由广泛的用途.
硫、氯及其化合物由广泛的用途.(1)“氯氧化法”是指在碱性条件下用Cl2将废水中的CN-氧化成无毒的物质,CN-被氧化后的产物为
(2)“氯胺(NH2Cl)消毒法”是在用液氯处理自来水的同时通入少量氨气,发生反应:Cl2+NH3=NH2Cl+HCl,生成的NH2Cl能部分水解生成强氧化性的物质,起消毒杀菌的作用.氯胺能用于消毒杀菌的原因是
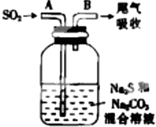
(3)如图所示装置和药品可用来制备Na2S2O3.
| 资料:25℃ H2CO3 Kal=4.4×10-7 H2S Kal=1.3×10-7 H2SO3 Kal=1.54×10-2 |
②配平广口瓶中生成Na2S2O3反应的化学方程式:
考点:氯、溴、碘及其化合物的综合应用,氧化还原反应方程式的配平,弱电解质在水溶液中的电离平衡
专题:氧化还原反应专题,卤族元素
分析:(1)碱性条件下用Cl2将废水中的CN-氧化成无毒的物质,应生成HCO3-(或者CO32-)、N2;
(2)NH2Cl能部分水解生成强氧化性的物质,应为HClO,可起消毒杀菌的作用;
(3)①酸的电离常数越大,酸性越强;
②从质量守恒的角度解答.
(2)NH2Cl能部分水解生成强氧化性的物质,应为HClO,可起消毒杀菌的作用;
(3)①酸的电离常数越大,酸性越强;
②从质量守恒的角度解答.
解答:
解:(1)碱性条件下用Cl2将废水中的CN-氧化成无毒的物质,应生成HCO3-(或者CO32-)、N2,故答案为:HCO3-(或者CO32-)、N2;
(2)NH2Cl能部分水解生成强氧化性的物质,应为HClO,可起消毒杀菌的作用,方程式为NH2Cl+H2O?NH3+HClO,故答案为:NH2Cl+H2O?NH3+HClO;
(3)①由表中数据可知,H2SO3的电离常数最大,酸性最强,H2S的电离常数最小,酸性最弱,则酸性强弱顺序为H2SO3>H2CO3>H2S,故答案为:H2SO3>H2CO3>H2S;
②由质量守恒定律可知反应方程式为4SO2+2Na2S+Na2CO3=3Na2S2O3+CO2,故答案为:4;2;1;3;1.
(2)NH2Cl能部分水解生成强氧化性的物质,应为HClO,可起消毒杀菌的作用,方程式为NH2Cl+H2O?NH3+HClO,故答案为:NH2Cl+H2O?NH3+HClO;
(3)①由表中数据可知,H2SO3的电离常数最大,酸性最强,H2S的电离常数最小,酸性最弱,则酸性强弱顺序为H2SO3>H2CO3>H2S,故答案为:H2SO3>H2CO3>H2S;
②由质量守恒定律可知反应方程式为4SO2+2Na2S+Na2CO3=3Na2S2O3+CO2,故答案为:4;2;1;3;1.
点评:本题考查较为综合,涉及物质的制备以及检验等知识,侧重与学生的分析能力和实验能力的考查,为高频考点,注意把握相关基础知识的学习,难度中等.

练习册系列答案
相关题目
从物质的量浓度为1.0mol/L的NaOH溶液1L中取出100mL,下列关于100mL溶液的叙述中正确的是( )
| A、物质的量浓度为0.1 mol/L |
| B、含NaOH 0.01 mol |
| C、NaOH的物质的量浓度为1.0 mol/L |
| D、含NaOH 1 g |
同温同压下,A容器中H2和B容器中NH3所含原子总数相等(两个容器中均只有一种气体),则A、B两容器的容积之比为( )
| A、1:2 | B、2:1 |
| C、2:3 | D、1:1 |
已知反应:①101kPa时,2C(s)+O2(g)═2CO(g)△H=-221kJ/mol;②稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol.
下列结论正确的是( )
下列结论正确的是( )
| A、稀硫酸与稀NaOH溶液的中和热为57.3 kJ/mol |
| B、①的反应热为221 kJ/mol |
| C、稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol |
| D、稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
在金属表面覆盖保护层是减缓金属腐蚀的常用方法,表面镀有保护金属层的铁片,当镀层有破损时能有效防止铁片腐蚀的是( )
| A、白铁(镀锌铁) |
| B、马口铁(镀锡铁) |
| C、镀金铁 |
| D、镀铜铁 |
关于实验室制取乙烯的实验,下列说法正确的是( )
| A、反应容器(烧瓶)注入酒精和稀硫酸的体积比为1:3 |
| B、反应物是乙醇和过量的3mol/L H2SO4混合液 |
| C、温度计应插入反应溶液液面下,以便控制温度 |
| D、反应完毕后先熄灭洒精灯,再从水中取出导管 |
下列关于热化学反应的描述中正确的是( )
| A、HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
| B、碳与二氧化碳的反应既是吸热反应,又是化合反应 |
| C、热化学方程式中化学计量数可表示分子个数 |
| D、1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
下列实验能达到目的是( )
| A、用湿润的碘化钾淀粉试纸鉴别Br2(g)和NO2 |
| B、用稀硫酸和锌粒反应制氢气时加入少许硫酸铜以加快反应速率 |
| C、用量筒量取10.00mL 1.00mol?L-1盐酸于100mL容量瓶中,加水稀释至刻度,可配制0.100 mol?L-1盐酸 |
| D、除去乙酸乙酯中混有的少量乙酸:加入NaOH溶液并加热,振荡、静置后分液 |