题目内容
6.下述实验设计能够达到目的是( )| A. | SO2中混有少量SO3,通过足量浓硫酸,收集气体 | |
| B. | HNO3溶液中混有少量H2SO4,加入适量BaCl2溶液,再过滤 | |
| C. | 提取溴水中的溴,可用加入乙醇萃取的方法 | |
| D. | 检验溶液中是否含有Fe2+,向溶液中滴入氯水后,再滴加KSCN溶液 |
分析 A.三氧化硫可被浓硫酸吸收;
B.引入新杂质;
C.乙醇与水混溶;
D.加入试剂顺序错误.
解答 解:A.三氧化硫易与水反应,可被浓硫酸吸收生成硫酸,可除杂,故A正确;
B.生成盐酸,引入新杂质,应用硝酸钡除杂,故B错误;
C.乙醇与水混溶,应用苯、四氯化碳等萃取剂,故C错误;
D.应先加入KSCN,再加入氯水检验,加入试剂顺序错误,故D错误.
故选A.
点评 本题考查混合物分离提纯以及鉴别,为高频考点,把握物质的性质、性质差异及发生的反应为解答的关键,侧重分析与应用能力的考查,注意物质性质的差异以及实验的严密性和可行性的评价,题目难度不大.

练习册系列答案
相关题目
16.常温下,下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A. | 0.1 mol•L-1 (NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+) | |
| B. | 0.1 mol•L-1 NaHCO3溶液:c(OH-)=c(H+)+2c(H2CO3)+c(HCO3-) | |
| C. | 0.1 mol•L-1Na2S溶液:2c(Na+)=c(S2-)+c(HS-)+c(H2S) | |
| D. | pH=12的NaOH溶液与等体积pH=2的醋酸混合后的溶液:c (CH3COO-)+c (OH-)=c (Na+)+c (H+) |
14.硫循环与碳循环是自然界中两种重要的元素循环过程,下列关于这两种循环的说法正确的是( )
| 选项 | 比较 | 碳循环 | 硫循环 |
| A | 异 | 碳元素会进入大气 | 硫元素不会进入大气 |
| B | 碳元素可以有机物形式参与循环 | 硫元素都以无机物形式参与循环 | |
| C | 同 | 人类活动对碳循环和硫循环都造成了巨大影响 | |
| D | 碳循环和硫循环对环境的影响是都能形成酸雨 | ||
| A. | A | B. | B | C. | C | D. | D |
1.按如图所示进行实验,以下叙述正确的是( )
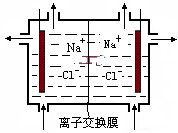

| A. | 离子交换膜既能让Na+通过,又能让OH-通过 | |
| B. | 阳极产生氯气和氢氧化钠 | |
| C. | 阴极区要定时添加饱和食盐水 | |
| D. | 阴极区流出的是氢氧化钠和氯化钠的混合溶液 |
15.下列说法正确的是( )
| A. | 常温常压下,22.4L氢气的物质的量为1mol | |
| B. | 标准状况下,11.2L水的物质的量为0.5mol | |
| C. | 标准状况下,32g硫的体积为22.4L | |
| D. | 常温常压下,22g二氧化碳的物质的量为0.5mol |
16.下列说法正确的是( )
| A. | 形成离子键的阴阳离子间只存在静电吸引力 | |
| B. | HF、HCl、HBr、HI的热稳定性依次增强 | |
| C. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 | |
| D. | 元素周期律是元素原子核外电子排布周期性变化的结果 |
 .
.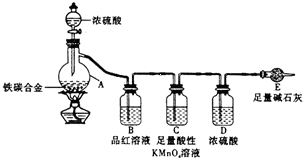 某学习小组设计了图示实验装置(省略了夹持仪器)来测定某铁碳合金中铁的质量分数.
某学习小组设计了图示实验装置(省略了夹持仪器)来测定某铁碳合金中铁的质量分数.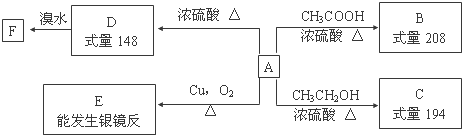
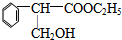 ,F的结构简式为
,F的结构简式为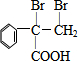 .
.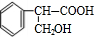 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$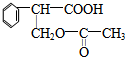 +H2O;②A→E:2
+H2O;②A→E:2 +2H2O.
+2H2O.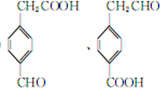 .
.