题目内容
由Mg、Fe、Cu组成的合金5g,加入到一定量稀硝酸溶液中,合金完全溶解,只收集到标况下2.24L NO,若向反应后的溶液中加入足量的NaOH溶液可生成沉淀 g.
考点:有关混合物反应的计算
专题:计算题
分析:由题意可知,金属全溶解,加足量的NaOH溶液后生成的沉淀为Cu(OH)2、Mg(OH)2、Fe(OH)3,还可能有Fe(OH)2,最终沉淀质量:m(沉淀)=m(金属混合物)+m(OH-),由于金属阳离子电荷总数等于金属离子结合的OH-得,即n(e-)=n(OH-),硝酸得的电子有关系式为:NO3-~NO~3e-,硝酸获得电子为0.3mol,以此计算沉淀的质量.
解答:
解:由Mg、Fe、Cu组成的合金5g,加入到一定量稀硝酸溶液中,合金完全溶解,加足量的NaOH溶液后生成的沉淀为Cu(OH)2、Mg(OH)2、Fe(OH)3,还可能有Fe(OH)2,但最终沉淀质量为:m(沉淀)=m(金属混合物)+m(OH-),
由于金属阳离子电荷总数等于金属离子结合的OH-得,即n(e-)=n(OH-),
标准状况下2.24LNO的物质的量为:n(NO)=
=0.1mol,
硝酸得的电子有关系式为:NO3-~NO~3e-,则硝酸获得电子为:0.1mol×3=0.3mol,
加入氢氧化钠溶液后生成沉淀的质量为:m(沉淀)=m(金属混合物)+m(OH-)=5g+17g/mol×0.3mol=10.1g,
故答案为:10.1.
由于金属阳离子电荷总数等于金属离子结合的OH-得,即n(e-)=n(OH-),
标准状况下2.24LNO的物质的量为:n(NO)=
| 2.24L |
| 22.4L/mol |
硝酸得的电子有关系式为:NO3-~NO~3e-,则硝酸获得电子为:0.1mol×3=0.3mol,
加入氢氧化钠溶液后生成沉淀的质量为:m(沉淀)=m(金属混合物)+m(OH-)=5g+17g/mol×0.3mol=10.1g,
故答案为:10.1.
点评:本题考查了有关混合物的反应,题目难度中等,明确生成沉淀的质量与生成NO得到电子之间关系“m(沉淀)=m(金属混合物)+m(OH-)”为解答关键,试题侧重考查学生的分析、理解能力及化学计算能力.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
下列物质反应的离子方程式不正确的是( )
| A、单质铜与稀硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O | ||||
| B、钠与硫酸铜溶液反应:Cu2++2Na=2Na++Cu | ||||
| C、向NaHCO3溶液中加入过量的Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O | ||||
D、用惰性电极电解饱和氯化钠溶液:2Cl-+2H2O
|


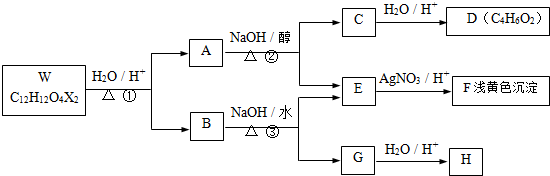




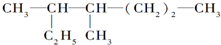 的名称是
的名称是