题目内容
实验室常用溴化钠,浓硫酸与乙醇共热来制取溴乙烷,其反应的化学方程式如下:
NaBr+H2SO4═NaHSO4+HBr C2H5OH+HBr
C2H5Br+H2O
试回答下列各问:
(1)第二步反应实际上是一个可逆反应,在实验中可采取 和 的措施,以提高溴乙烷的产率.
(2)浓H2SO4在实验中的作用是 ,其用量(物质的量)应 NaBr的用量(填大于、等于或小于).
(3)实验中可能发生的有机副反应(用化学方程式表示)是 和 .
NaBr+H2SO4═NaHSO4+HBr C2H5OH+HBr
| △ |
试回答下列各问:
(1)第二步反应实际上是一个可逆反应,在实验中可采取
(2)浓H2SO4在实验中的作用是
(3)实验中可能发生的有机副反应(用化学方程式表示)是
考点:溴乙烷的制取
专题:
分析:(1)根据影响化学平衡移动的因素知识来回答判断;
(2)根据反应的实质结合制取实验原理来确定物质的作用以及用量的大小;
(3)乙醇在浓硫酸的作用下,不同的温度发生的反应不一样,可能会产生乙醚和乙烯,据此回答.
(2)根据反应的实质结合制取实验原理来确定物质的作用以及用量的大小;
(3)乙醇在浓硫酸的作用下,不同的温度发生的反应不一样,可能会产生乙醚和乙烯,据此回答.
解答:
解:(1)反应C2H5OH+HBr?C2H5Br+H2O是可逆的,增大某种反应物的量,或是减小某种生成物的量,都可以使得使平衡正向移动,
故答案为:增大某种反应物的量,如加过量NaBr以增加HBr的量;减小某种生成物的量,以使平衡正向移动,如加过量浓H2SO4吸水;
(2)浓硫酸在反应:NaBr+H2SO4═NaHSO4+HBr中是反应物,在C2H5OH+HBr
C2H5Br+H2O中是吸水剂,根据第一个反应知道硫酸和溴化钠的物质的量是相等的,但是为了在第二个反应中起到催化剂的作用,所以硫酸用量应大于NaBr的用量,故答案为:在第一个反应中是反应物,在第二个反应中是吸水剂;大于;
(3)乙醇在浓硫酸的作用下,不同的温度发生的反应不一样,可能会产生乙醚和乙烯,即:2C2H5OH
C2H5OC2H5+H2O,C2H5OH
C2H4↑+H2O,
故答案为:2C2H5OH
C2H5OC2H5+H2O;C2H5OH
C2H4↑+H2O.
故答案为:增大某种反应物的量,如加过量NaBr以增加HBr的量;减小某种生成物的量,以使平衡正向移动,如加过量浓H2SO4吸水;
(2)浓硫酸在反应:NaBr+H2SO4═NaHSO4+HBr中是反应物,在C2H5OH+HBr
| △ |
(3)乙醇在浓硫酸的作用下,不同的温度发生的反应不一样,可能会产生乙醚和乙烯,即:2C2H5OH
| 140℃ |
| 浓硫酸 |
| 170℃ |
| 浓硫酸 |
故答案为:2C2H5OH
| 140℃ |
| 浓硫酸 |
| 170℃ |
| 浓硫酸 |
点评:本题综合考查学生乙醇的化学性质以及应用等方面的知识,注意知识的归纳和梳理是解题的关键,难度中等.

练习册系列答案
相关题目
某有机物的结构简式为: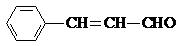 ,则关于该有机物的说法正确的是( )
,则关于该有机物的说法正确的是( )
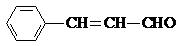 ,则关于该有机物的说法正确的是( )
,则关于该有机物的说法正确的是( )| A、1 mol该有机物发生银镜反应能生成 1 mol Ag |
| B、1 mol该有机物最多能够与6 mol H2 发生加成反应 |
C、它与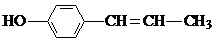 互为同分异构体 互为同分异构体 |
| D、该有机物能被酸性高锰酸钾溶液氧化 |



 如图是用石墨和铁作电极电解饱和食盐水的装置,请填空:
如图是用石墨和铁作电极电解饱和食盐水的装置,请填空: