题目内容
有机物W~H 有如图的转化关系.已知W、B为芳香族化合物,X为卤素原子,W、A、B均能与NaHCO3溶液反应,A分子中有2个甲基,H分子中含有醛基且苯环上的取代基处于对位.

已知:

请回答下列有关问题:
(1)反应①、②分别属于 反应、 反应(填有机反应类型),A、B中均含有的含氧官能团的名称是 .
(2)F的化学式 ,B的结构简式 .
(3)反应②的化学方程式是
(4)若发生反应

有机玻璃[(C5H8O2)n],则反应④的化学方程式是: .
(5)H有多种同分异构体,且满足下列3个条件
(i)遇FeCl3显紫色
( ii)苯环上一取代物有两种
(ⅲ)除苯环外无其它环状结构
请任意写出1种符合条件的物质的结构简式 .

已知:

| 自动脱水 |

请回答下列有关问题:
(1)反应①、②分别属于
(2)F的化学式
(3)反应②的化学方程式是
(4)若发生反应

| 醇 |
| 浓H2SO4/△④ |

| 催化剂 |
(5)H有多种同分异构体,且满足下列3个条件
(i)遇FeCl3显紫色
( ii)苯环上一取代物有两种
(ⅲ)除苯环外无其它环状结构
请任意写出1种符合条件的物质的结构简式
考点:有机物的推断
专题:有机物的化学性质及推断
分析:W、A、B均能与NaHCO3溶液反应,均含有羧基,W在酸性条件下水解得到A与B,W中含有酯基,A发生消去反应、B发生水解反应均得到E,E与硝酸银反应得到淡黄色沉淀,故X为Br元素,E为NaBr,F为AgBr;A、B分子中均含有Br原子,B在氢氧化钠水溶液、加热条件下发生水解反应得到G,G酸化得到H,H分子中含有醛基且苯环上的取代基处于对位,则H为 ,结合碳原子碳原子连接2个羟基不稳定,自动转化为羰基,可推知B为
,结合碳原子碳原子连接2个羟基不稳定,自动转化为羰基,可推知B为 ,则G为
,则G为 ;A在氢氧化钠醇溶液、加热条件下发生消去反应得到C,C酸化得到D,A分子中有2个甲基,结合D的分子式可知,A为(CH3)2CBrCOOH,则C为CH2=C(CH3)COONa,D为CH2=C(CH3)COOH,综上分析可知X为
;A在氢氧化钠醇溶液、加热条件下发生消去反应得到C,C酸化得到D,A分子中有2个甲基,结合D的分子式可知,A为(CH3)2CBrCOOH,则C为CH2=C(CH3)COONa,D为CH2=C(CH3)COOH,综上分析可知X为 ,据此解答.
,据此解答.
 ,结合碳原子碳原子连接2个羟基不稳定,自动转化为羰基,可推知B为
,结合碳原子碳原子连接2个羟基不稳定,自动转化为羰基,可推知B为 ,则G为
,则G为 ;A在氢氧化钠醇溶液、加热条件下发生消去反应得到C,C酸化得到D,A分子中有2个甲基,结合D的分子式可知,A为(CH3)2CBrCOOH,则C为CH2=C(CH3)COONa,D为CH2=C(CH3)COOH,综上分析可知X为
;A在氢氧化钠醇溶液、加热条件下发生消去反应得到C,C酸化得到D,A分子中有2个甲基,结合D的分子式可知,A为(CH3)2CBrCOOH,则C为CH2=C(CH3)COONa,D为CH2=C(CH3)COOH,综上分析可知X为 ,据此解答.
,据此解答.解答:
解:W、A、B均能与NaHCO3溶液反应,均含有羧基,W在酸性条件下水解得到A与B,W中含有酯基,A发生消去反应、B发生水解反应均得到E,E与硝酸银反应得到淡黄色沉淀,故X为Br元素,E为NaBr,F为AgBr.A、B分子中均含有Br原子,B在氢氧化钠水溶液、加热条件下发生水解反应得到G,G酸化得到H,H分子中含有醛基且苯环上的取代基处于对位,则H为 ,结合碳原子碳原子连接2个羟基不稳定,自动转化为羰基,可推知B为
,结合碳原子碳原子连接2个羟基不稳定,自动转化为羰基,可推知B为 ,则G为
,则G为 .A在氢氧化钠醇溶液、加热条件下发生消去反应得到C,C酸化得到D,A分子中有2个甲基,结合D的分子式可知,A为(CH3)2CBrCOOH,则C为CH2=C(CH3)COONa,D为CH2=C(CH3)COOH,综上分析可知X为
.A在氢氧化钠醇溶液、加热条件下发生消去反应得到C,C酸化得到D,A分子中有2个甲基,结合D的分子式可知,A为(CH3)2CBrCOOH,则C为CH2=C(CH3)COONa,D为CH2=C(CH3)COOH,综上分析可知X为 ,
,
(1)①是W发生水解或取代反应,②是A发生消去反应,A为(CH3)2CBrCOOH、B为 ,A、B中都含有的含氧官能团是羧基,故答案为:水解(或取代);消去;羧基;
,A、B中都含有的含氧官能团是羧基,故答案为:水解(或取代);消去;羧基;
(2)通过以上分析知,F为AgBr,B结构简式为 ,故答案为:AgBr;
,故答案为:AgBr; ;
;
(3)反应②为A发生消去反应,反应方程式为 ,故答案为:
,故答案为: ;
;
(4)D为CH2=C(CH3)COOH,D和醇发生酯化反应生成L,L发生加聚反应生成有机玻璃,根据C原子守恒知,该醇为甲醇,则反应④的方程式为 ,故答案为:
,故答案为: ;
;
(5)H为 ,H的同分异构体符合下列条件:
,H的同分异构体符合下列条件:
(i)遇FeCl3显紫色说明具有酚羟基;
( ii)苯环上一取代物有两种说明苯环上有两类H原子;
(ⅲ)除苯环外无其它环状结构,
如果含有一个酚羟基、两个醛基,则两个醛基位于酚羟基的邻位或间位,如果含有一个酚羟基、一个-COCHO,则两个取代基位于对位,所以符合条件的H同分异构体有 、
、 、
、 ,故答案为:
,故答案为: 、
、 、
、 等中的任意一种.
等中的任意一种.
 ,结合碳原子碳原子连接2个羟基不稳定,自动转化为羰基,可推知B为
,结合碳原子碳原子连接2个羟基不稳定,自动转化为羰基,可推知B为 ,则G为
,则G为 .A在氢氧化钠醇溶液、加热条件下发生消去反应得到C,C酸化得到D,A分子中有2个甲基,结合D的分子式可知,A为(CH3)2CBrCOOH,则C为CH2=C(CH3)COONa,D为CH2=C(CH3)COOH,综上分析可知X为
.A在氢氧化钠醇溶液、加热条件下发生消去反应得到C,C酸化得到D,A分子中有2个甲基,结合D的分子式可知,A为(CH3)2CBrCOOH,则C为CH2=C(CH3)COONa,D为CH2=C(CH3)COOH,综上分析可知X为 ,
,(1)①是W发生水解或取代反应,②是A发生消去反应,A为(CH3)2CBrCOOH、B为
 ,A、B中都含有的含氧官能团是羧基,故答案为:水解(或取代);消去;羧基;
,A、B中都含有的含氧官能团是羧基,故答案为:水解(或取代);消去;羧基;(2)通过以上分析知,F为AgBr,B结构简式为
 ,故答案为:AgBr;
,故答案为:AgBr; ;
;(3)反应②为A发生消去反应,反应方程式为
 ,故答案为:
,故答案为: ;
;(4)D为CH2=C(CH3)COOH,D和醇发生酯化反应生成L,L发生加聚反应生成有机玻璃,根据C原子守恒知,该醇为甲醇,则反应④的方程式为
 ,故答案为:
,故答案为: ;
;(5)H为
 ,H的同分异构体符合下列条件:
,H的同分异构体符合下列条件:(i)遇FeCl3显紫色说明具有酚羟基;
( ii)苯环上一取代物有两种说明苯环上有两类H原子;
(ⅲ)除苯环外无其它环状结构,
如果含有一个酚羟基、两个醛基,则两个醛基位于酚羟基的邻位或间位,如果含有一个酚羟基、一个-COCHO,则两个取代基位于对位,所以符合条件的H同分异构体有
 、
、 、
、 ,故答案为:
,故答案为: 、
、 、
、 等中的任意一种.
等中的任意一种.
点评:本题考查有机物推断,侧重考查分析推断能力,根据反应条件、物质中官能团与性质的关系等采用正逆结合的方法进行推断,难点是限制性条件同分异构体种类的判断,题目难度中等.

练习册系列答案
相关题目
某有机物的结构简式为: ,则关于该有机物的说法正确的是( )
,则关于该有机物的说法正确的是( )
 ,则关于该有机物的说法正确的是( )
,则关于该有机物的说法正确的是( )| A、1 mol该有机物发生银镜反应能生成 1 mol Ag |
| B、1 mol该有机物最多能够与6 mol H2 发生加成反应 |
C、它与 互为同分异构体 互为同分异构体 |
| D、该有机物能被酸性高锰酸钾溶液氧化 |
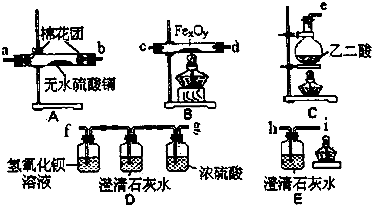

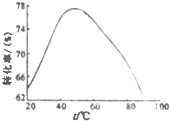 蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
蛇纹石可用于生产氢氧化镁,简要工艺流程如下: