题目内容
酸、碱、盐在水溶液中的反应是中学化学研究的主题.
(1)0.4mol/L的NaOH溶液与0.2mol/L HnA溶液等体积混合后pH=10,则HnA是 (①一元强酸 ②一元弱酸 ③二元强酸 ④二元弱酸),理由是 .
(2)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,则下面图象正确的是 (填图象符号)
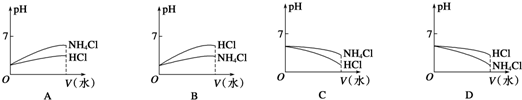
(3)已知PbI2的Ksp=7.0×10-9,将1.0×10-2mol/L的KI与Pb(NO3)2溶液等体积混合,则生成PbI2沉淀所需Pb(NO3)2溶液的最小浓度为 .
(4)在25℃下,将a mol/L的氨水与0.1mol/L的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显 性(填“酸”“碱”或“中”);用含a的代数式表示NH3?H2O的电离常数Kb= .
(5)等体积的pH均为4的盐酸与NH4Cl溶液中,发生电离的水的物质的量前者与后者的比值为 .
(6)已知KBiO3+MnSO4+H2SO4→Bi2(SO4)3+KMnO4+H2O+K2SO4(未配平),利用上述化学反应设计成如图所示原电池,其盐桥中装有饱和K2SO4溶液.
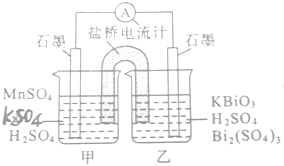
①电池工作时,盐桥中的K+移向 (填“甲”或“乙”烧杯)
②甲烧杯中发生反应的电极方程式为 .
(1)0.4mol/L的NaOH溶液与0.2mol/L HnA溶液等体积混合后pH=10,则HnA是
(2)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,则下面图象正确的是

(3)已知PbI2的Ksp=7.0×10-9,将1.0×10-2mol/L的KI与Pb(NO3)2溶液等体积混合,则生成PbI2沉淀所需Pb(NO3)2溶液的最小浓度为
(4)在25℃下,将a mol/L的氨水与0.1mol/L的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显
(5)等体积的pH均为4的盐酸与NH4Cl溶液中,发生电离的水的物质的量前者与后者的比值为
(6)已知KBiO3+MnSO4+H2SO4→Bi2(SO4)3+KMnO4+H2O+K2SO4(未配平),利用上述化学反应设计成如图所示原电池,其盐桥中装有饱和K2SO4溶液.

①电池工作时,盐桥中的K+移向
②甲烧杯中发生反应的电极方程式为
考点:酸碱混合时的定性判断及有关ph的计算,原电池和电解池的工作原理,盐类水解的原理,难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:(1)根据混合液pH=10可知,混合液为碱性,然后分别讨论得出该酸为二元弱酸;
(2)pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,氯化铵溶液的pH变化较小,氯化氢溶液的pH变化较大,据此判断;
(3)将1.0×10-2 mol/L的KI与Pb(NO3)2溶液等体积混合,c(I-)=0.5×10-2 mol/L,如生成沉淀,应满足c2(I-)×c(Pb2+)≥7.0×10-9,以此计算;
(4)25℃时,混合溶液呈存在电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-),因为存在c(NH4+)=c(Cl-),所以c(H+)=c(OH-),溶液呈中性,所以c(H+)=c(OH-)=10-7 mol/L,混合后溶液体积增大一倍,所以溶液中c(Cl-)=0.05mol/L,c(NH3?H2O)=0.5amol/L-c(NH4+)=0.5amol/L-0.05mol/L,Kb=
;
(5)盐酸中的氢氧根离子是水电离的,氯化铵中的氢离子是水电离的,据此进行计算;
(6)根据反应KBiO3+MnSO4+H2SO4→Bi2(SO4)3+KMnO4+H2O+K2SO4中化合价变化及原电池工作原理判断电流方向,根据图示甲烧杯中的溶质形成其电极方程式.
(2)pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,氯化铵溶液的pH变化较小,氯化氢溶液的pH变化较大,据此判断;
(3)将1.0×10-2 mol/L的KI与Pb(NO3)2溶液等体积混合,c(I-)=0.5×10-2 mol/L,如生成沉淀,应满足c2(I-)×c(Pb2+)≥7.0×10-9,以此计算;
(4)25℃时,混合溶液呈存在电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-),因为存在c(NH4+)=c(Cl-),所以c(H+)=c(OH-),溶液呈中性,所以c(H+)=c(OH-)=10-7 mol/L,混合后溶液体积增大一倍,所以溶液中c(Cl-)=0.05mol/L,c(NH3?H2O)=0.5amol/L-c(NH4+)=0.5amol/L-0.05mol/L,Kb=
| c(NH4+)?c(OH-) |
| c(NH3?H2O) |
(5)盐酸中的氢氧根离子是水电离的,氯化铵中的氢离子是水电离的,据此进行计算;
(6)根据反应KBiO3+MnSO4+H2SO4→Bi2(SO4)3+KMnO4+H2O+K2SO4中化合价变化及原电池工作原理判断电流方向,根据图示甲烧杯中的溶质形成其电极方程式.
解答:
解:(1)混合液的pH=10,说明反应后溶液显碱性,设两种溶液都是1L,反应之前氢氧根离子的物质的量为0.4mol,如果HnA是二元强酸,则反应前氢离子的物质的量为0.4mol,氢离子和氢氧根离子完全反应,反应后溶液为中性;如果HnA是一元强酸,反应前氢离子的物质的量为0.2mol,混合液中氢氧根离子浓度为0.1mol/L,反应后溶液的pH=13,若为由于弱酸,则溶液的pH>13,故HA为二元弱酸,
故答案为:④;生成正盐水解显碱性;
(2)pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,氯化铵溶液中铵根离子水解导致溶液显示酸性,稀释后铵根离子水解程度增大,溶液中氢离子的物质的量增大,而氯化氢为强电解质,稀释过程中氢离子浓度减小,所以稀释后两溶液的pH都增大,且氯化氢溶液的pH变化较大,通过观察图象可知,正确的选项为B,
故答案为:B;
(3)将1.0×10-2 mol/L的KI与Pb(NO3)2溶液等体积混合,c(I-)=0.5×10-2 mol/L,
如生成沉淀,应满足c2(I-)×c(Pb2+)≥7.0×10-9,
则c(Pb2+)≥
mol/L=2.8×10-4mol/L,
则所需Pb(NO3)2溶液的最小浓度为:2×2.8×10-4mol/L=5.6×10-4mol/L,
故答案为:5.6×10-4mol/L;
(4)25℃时,混合溶液呈存在电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-),因为存在c(NH4+)=c(Cl-),所以c(H+)=c(OH-),溶液呈中性,所以c(H+)=c(OH-)=10-7 mol/L,混合后溶液体积增大一倍,所以溶液中c(Cl-)=0.05mol/L,c(NH4+)=c(Cl-)=0.05mol/L,c(NH3?H2O)=0.5amol/L-c(NH4+)=0.5amol/L-0.005mol/L,Kb=
=
mol/L=
mol/L,
故答案为:中性;
mol/L;
(5)等体积的pH均为4的盐酸中氢离子浓度抑制了水的电离,则盐酸中氢氧根离子是水电离的,则水电离的氢离子为10-10mol/L;
pH=4的NH4Cl溶液中,铵根离子水解促进了水的电离,则水电离的氢离子为10-4mol/L,所以发生电离的水的物质的量前者与后者的比值为:10-10mol/L:10-4mol/L=10-6,
故答案为:10-6;
(6)①反应KBiO3+MnSO4+H2SO4→Bi2(SO4)3+KMnO4+H2O+K2SO4中,KBiO3→Bi2(SO4)3,Bi元素化合价降低被还原,MnSO4→KMnO4,Mn元素化合价升高被氧化,则该原电池中负极变化为:MnSO4→KMnO4,正极变化为:KBiO3→Bi2(SO4)3,
所以甲烧杯中发生的反应为负极反应,乙烧杯中为正极反应,电子从甲烧杯的石墨流向乙烧杯的石墨,即甲为负极、乙为正极,
盐桥中钾离子带正电荷,其移动方向与电流方向一致,则钾离子从甲烧杯流向乙,
故答案为:乙;
②根据分析可知,甲烧杯中锰离子失去电子生成高锰酸根离子,其电极反应式为:Mn2+-5e-+4H2O=MnO4-+8H+,故答案为:Mn2+-5e-+4H2O=MnO4-+8H+.
故答案为:④;生成正盐水解显碱性;
(2)pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,氯化铵溶液中铵根离子水解导致溶液显示酸性,稀释后铵根离子水解程度增大,溶液中氢离子的物质的量增大,而氯化氢为强电解质,稀释过程中氢离子浓度减小,所以稀释后两溶液的pH都增大,且氯化氢溶液的pH变化较大,通过观察图象可知,正确的选项为B,
故答案为:B;
(3)将1.0×10-2 mol/L的KI与Pb(NO3)2溶液等体积混合,c(I-)=0.5×10-2 mol/L,
如生成沉淀,应满足c2(I-)×c(Pb2+)≥7.0×10-9,
则c(Pb2+)≥
| 7.0×10-9 |
| (0.5×10-2)2 |
则所需Pb(NO3)2溶液的最小浓度为:2×2.8×10-4mol/L=5.6×10-4mol/L,
故答案为:5.6×10-4mol/L;
(4)25℃时,混合溶液呈存在电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-),因为存在c(NH4+)=c(Cl-),所以c(H+)=c(OH-),溶液呈中性,所以c(H+)=c(OH-)=10-7 mol/L,混合后溶液体积增大一倍,所以溶液中c(Cl-)=0.05mol/L,c(NH4+)=c(Cl-)=0.05mol/L,c(NH3?H2O)=0.5amol/L-c(NH4+)=0.5amol/L-0.005mol/L,Kb=
| c(NH4+)?c(OH-) |
| c(NH3?H2O) |
| 0.05×10-7 |
| 0.5a-0.05 |
| 10-8 |
| a-0.1 |
故答案为:中性;
| 10-8 |
| a-0.1 |
(5)等体积的pH均为4的盐酸中氢离子浓度抑制了水的电离,则盐酸中氢氧根离子是水电离的,则水电离的氢离子为10-10mol/L;
pH=4的NH4Cl溶液中,铵根离子水解促进了水的电离,则水电离的氢离子为10-4mol/L,所以发生电离的水的物质的量前者与后者的比值为:10-10mol/L:10-4mol/L=10-6,
故答案为:10-6;
(6)①反应KBiO3+MnSO4+H2SO4→Bi2(SO4)3+KMnO4+H2O+K2SO4中,KBiO3→Bi2(SO4)3,Bi元素化合价降低被还原,MnSO4→KMnO4,Mn元素化合价升高被氧化,则该原电池中负极变化为:MnSO4→KMnO4,正极变化为:KBiO3→Bi2(SO4)3,
所以甲烧杯中发生的反应为负极反应,乙烧杯中为正极反应,电子从甲烧杯的石墨流向乙烧杯的石墨,即甲为负极、乙为正极,
盐桥中钾离子带正电荷,其移动方向与电流方向一致,则钾离子从甲烧杯流向乙,
故答案为:乙;
②根据分析可知,甲烧杯中锰离子失去电子生成高锰酸根离子,其电极反应式为:Mn2+-5e-+4H2O=MnO4-+8H+,故答案为:Mn2+-5e-+4H2O=MnO4-+8H+.
点评:本题考查了酸碱混合的定性判断、原电池工作原理、盐的水解原理等知识,题目难度较大,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及综合应用所学知识的能力.

练习册系列答案
相关题目
对于可逆反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列正确的是( )
A、平衡常数的表达式K=
| ||
| B、当v正(NH3):v正(NO)=1:1时,说明该反应已经达到平衡 | ||
| C、若平衡时两种反应物的转化率相等,则起始投入的n(NH3):n(O2)=5:4 | ||
| D、反应达到平衡后,恒容条件下,同倍数改变NH3和NO的量,c(O2)=可能不变 |
下列实验装置与实验操作正确的是( )


| A、①④⑥ | B、④⑥ |
| C、①②④⑤ | D、④⑤⑥ |
对于苯乙烯 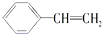 的下列叙述:①能使酸性KMnO4溶液褪色,②可发生加聚反应,③可溶于水,④可溶于苯中,⑤苯环能与溴水发生取代反应,⑥所有的原子可能共面.其中完全正确的是( )
的下列叙述:①能使酸性KMnO4溶液褪色,②可发生加聚反应,③可溶于水,④可溶于苯中,⑤苯环能与溴水发生取代反应,⑥所有的原子可能共面.其中完全正确的是( )
 的下列叙述:①能使酸性KMnO4溶液褪色,②可发生加聚反应,③可溶于水,④可溶于苯中,⑤苯环能与溴水发生取代反应,⑥所有的原子可能共面.其中完全正确的是( )
的下列叙述:①能使酸性KMnO4溶液褪色,②可发生加聚反应,③可溶于水,④可溶于苯中,⑤苯环能与溴水发生取代反应,⑥所有的原子可能共面.其中完全正确的是( )| A、①②④ | B、①②④⑥ |
| C、①②④⑤⑥ | D、①②③④⑤⑥ |
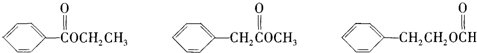
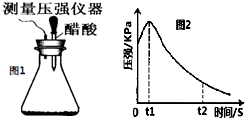 某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化.
某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化.