题目内容
已知黄钠铁矾[NaxFey(SO4)m(OH)n]具有沉淀颗粒大、沉淀速率快、容易过滤等特点.某研究小组先将某废水中Fe2+氧化为Fe3+,再加入Na2SO4使其生成黄钠铁矾而除去.该小组为测定黄钠铁矾的组成,进行了如下实验:
①称取4.850g样品,加盐酸完全溶解后,配成100.00mL溶液A;
②量取25.00mL溶液A,加入足量的KI,用0.2500mol?L-1Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3=2NaI+Na2S4O6),消耗30.00mLNa2S2O3溶液至终点.
③另取25.00mL溶液A,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥后得沉淀1.165g.
(1)该小组不采用生成Fe(OH)3沉淀的方法除去铁元素,是因为生成的Fe(OH)3 .
(2)用Na2S2O3溶液进行滴定时,使用的指示剂为 ,滴定到终点的颜色变化为 .
(3)通过计算确定黄钠铁矾的化学式(写出计算过程).
①称取4.850g样品,加盐酸完全溶解后,配成100.00mL溶液A;
②量取25.00mL溶液A,加入足量的KI,用0.2500mol?L-1Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3=2NaI+Na2S4O6),消耗30.00mLNa2S2O3溶液至终点.
③另取25.00mL溶液A,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥后得沉淀1.165g.
(1)该小组不采用生成Fe(OH)3沉淀的方法除去铁元素,是因为生成的Fe(OH)3
(2)用Na2S2O3溶液进行滴定时,使用的指示剂为
(3)通过计算确定黄钠铁矾的化学式(写出计算过程).
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)由题给信息,黄钠铁矾[NaxFey(SO4)m(OH)n]具有沉淀颗粒大、沉淀速率快、容易过滤等特点,得出生成氢氧化铁沉淀的特点;
(2)碘遇淀粉变蓝色,故选择淀粉作指示剂,当溶液由蓝色变为无色,且半分钟颜色不再变化说明滴定到达终点;
(3)测定黄钠铁矾的原理是,加入碘化钾和黄钠铁矾中铁离子反应生成单质碘,碘和硫代硫酸钠反应,通过消耗硫代硫酸钠的量来计算铁的量,加入足量氯化钡和硫酸根离子生成硫酸钡沉淀,通过硫酸钡沉淀来计算硫酸根离子的量,根据质量守恒和电荷守恒计算钠离子和氢氧根离子的量,根据各微量物质的量之比写出黄钠铁矾的化学式.
(2)碘遇淀粉变蓝色,故选择淀粉作指示剂,当溶液由蓝色变为无色,且半分钟颜色不再变化说明滴定到达终点;
(3)测定黄钠铁矾的原理是,加入碘化钾和黄钠铁矾中铁离子反应生成单质碘,碘和硫代硫酸钠反应,通过消耗硫代硫酸钠的量来计算铁的量,加入足量氯化钡和硫酸根离子生成硫酸钡沉淀,通过硫酸钡沉淀来计算硫酸根离子的量,根据质量守恒和电荷守恒计算钠离子和氢氧根离子的量,根据各微量物质的量之比写出黄钠铁矾的化学式.
解答:
解:(1)由题给信息,黄钠铁矾[NaxFey(SO4)m(OH)n]具有沉淀颗粒大、沉淀速率快、容易过滤等特点,则生成氢氧化铁沉淀具有沉淀颗粒小、速度慢、不容易过滤的特点;故答案为:沉淀颗粒小、沉淀速率慢、不容易过滤;
(2)碘遇淀粉变蓝色,故选择淀粉作指示剂,当溶液由蓝色变为无色,且半分钟颜色不再变化说明滴定到达终点;
故答案为:淀粉;溶液由蓝色变为无色,且半分钟内不再恢复;
(3)有关的反应离子方程式为:2Fe3++2I-=2Fe2++I2,I2+2Na2S2O3=2NaI+Na2S4O6,
2Fe3+~I2~2Na2S2O3
n(Fe3+)=2n(I2)=n(Na2S2O3)=0.2500 mol?L-1×30.00 mL×10-3L?mL-1=7.50×10-3 mol;
加足量BaCl2溶液充分反应后,过滤、洗涤、干燥后得沉淀1.165g为硫酸钡沉淀,则n(SO42-)=
=5.00×10-3mol
100 mL溶液中含有n(Fe3+)=7.50×10-3 mol×
=0.03 mol,n(SO42-)=5.00×10-3 mol×
=0.02 mol,
设4.850g样品中钠离子的物质的量为n(Na+),氢氧根离子物质的量为n(OH-),
根据质量守恒得:4.850g-0.03mol×56g/mol-0.02mol×96g/mol=n(Na+)×23g/mol+n(OH-)×17g/mol
根据电荷守恒得:0.03mol×3+n(Na+)×1=0.02mol×2+n(OH-)×1
解得:n(Na+)=0.01 mol,n(OH-)=0.06 mol,
x:y:m:n=n(Na+):n(Fe3+):n(SO42-):n(OH-)=0.01:0.03:0.02:0.06=1:3:2:6,
化学式为NaFe3(SO4)2(OH)6,
答:黄钠铁矾的化学式为:NaFe3(SO4)2(OH)6.
(2)碘遇淀粉变蓝色,故选择淀粉作指示剂,当溶液由蓝色变为无色,且半分钟颜色不再变化说明滴定到达终点;
故答案为:淀粉;溶液由蓝色变为无色,且半分钟内不再恢复;
(3)有关的反应离子方程式为:2Fe3++2I-=2Fe2++I2,I2+2Na2S2O3=2NaI+Na2S4O6,
2Fe3+~I2~2Na2S2O3
n(Fe3+)=2n(I2)=n(Na2S2O3)=0.2500 mol?L-1×30.00 mL×10-3L?mL-1=7.50×10-3 mol;
加足量BaCl2溶液充分反应后,过滤、洗涤、干燥后得沉淀1.165g为硫酸钡沉淀,则n(SO42-)=
| 1.165g |
| 233g/mol |
100 mL溶液中含有n(Fe3+)=7.50×10-3 mol×
| 100mL |
| 25mL |
| 100mL |
| 25mL |
设4.850g样品中钠离子的物质的量为n(Na+),氢氧根离子物质的量为n(OH-),
根据质量守恒得:4.850g-0.03mol×56g/mol-0.02mol×96g/mol=n(Na+)×23g/mol+n(OH-)×17g/mol
根据电荷守恒得:0.03mol×3+n(Na+)×1=0.02mol×2+n(OH-)×1
解得:n(Na+)=0.01 mol,n(OH-)=0.06 mol,
x:y:m:n=n(Na+):n(Fe3+):n(SO42-):n(OH-)=0.01:0.03:0.02:0.06=1:3:2:6,
化学式为NaFe3(SO4)2(OH)6,
答:黄钠铁矾的化学式为:NaFe3(SO4)2(OH)6.
点评:本题考查黄钠铁矾组成的测定,中等难度,计算时要搞清反应原理,充分利用质量守恒和电荷守恒计算出钠离子和氢氧根离子的物质的量是解题的关键.要细心计算,注意从100mL中取出25mL进行滴定和形成沉淀,容易出错.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
向某盐溶液中滴加Ba(NO3)2溶液和过量的稀盐酸,有白色沉淀生成,则原溶液可能是( )
| A、KNO3溶液 |
| B、CaCl2溶液 |
| C、Na2SO4溶液 |
| D、Na2CO3溶液 |
对于苯乙烯 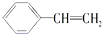 的下列叙述:①能使酸性KMnO4溶液褪色,②可发生加聚反应,③可溶于水,④可溶于苯中,⑤苯环能与溴水发生取代反应,⑥所有的原子可能共面.其中完全正确的是( )
的下列叙述:①能使酸性KMnO4溶液褪色,②可发生加聚反应,③可溶于水,④可溶于苯中,⑤苯环能与溴水发生取代反应,⑥所有的原子可能共面.其中完全正确的是( )
 的下列叙述:①能使酸性KMnO4溶液褪色,②可发生加聚反应,③可溶于水,④可溶于苯中,⑤苯环能与溴水发生取代反应,⑥所有的原子可能共面.其中完全正确的是( )
的下列叙述:①能使酸性KMnO4溶液褪色,②可发生加聚反应,③可溶于水,④可溶于苯中,⑤苯环能与溴水发生取代反应,⑥所有的原子可能共面.其中完全正确的是( )| A、①②④ | B、①②④⑥ |
| C、①②④⑤⑥ | D、①②③④⑤⑥ |
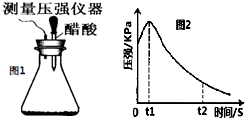 某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化.
某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化.
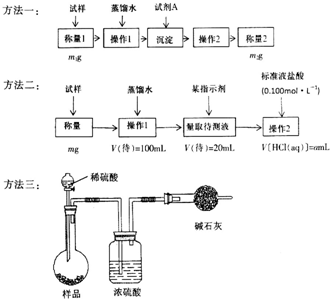 欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法.
欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法. 已知A、B、C、D、E五种元素的性质或结构信息如下,请根据信息回答下列问题:
已知A、B、C、D、E五种元素的性质或结构信息如下,请根据信息回答下列问题: