题目内容
已知 250C 时人Ksp[Fe(OH)3]=8x10-39,该温度下反应 Fe(OH)3+3H+?Fe3++3H20的平衡常数为 .(列式并计算)向0.001mol/L FeCl3溶液中通人氨气(体积变化忽略不计),开始沉淀时溶液的pH为 .(lg5=0.7)
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:根据Fe(OH)3中Fe(OH)3?Fe3++3OH-,Ksp[Fe(OH)3]=c3(OH-)×c(Fe3+),根据K的表达式计算;根据Ksp[Fe(OH)3]和0.001mol/L FeCl3的计算氢氧根离子和氢离子,再求pH.
解答:
解:Fe(OH)3中Fe(OH)3?Fe3++3OH-Ksp[Fe(OH)3]=c3(OH-)×c(Fe3+),c(H+)=
,
反应Fe(OH)3+3H+?Fe3++3H20的平衡常数K=
=
=8×103;
0.001mol/L FeCl3溶液中c(Fe3+)=0.001mol/L,则形成Fe(OH)3饱和溶液时c3(OH-)=
,则c(OH-)=
=2×10-12mol/L,
则c(H+)=
=5×10-3mol/L,所以pH=2.3,即开始沉淀时溶液的pH为2.3.
故答案为:8×103;2.3.
| 10-14 |
| c(OH-) |
反应Fe(OH)3+3H+?Fe3++3H20的平衡常数K=
| c(Fe3+) |
| c3(H+) |
| ||
(
|
0.001mol/L FeCl3溶液中c(Fe3+)=0.001mol/L,则形成Fe(OH)3饱和溶液时c3(OH-)=
| Ksp[Fe(OH)3] |
| c(Fe3+) |
| 3 |
| ||
则c(H+)=
| 10-14 |
| c(OH-) |
故答案为:8×103;2.3.
点评:本题考查了溶度积常数的计算、平衡常数的计算等,侧重于考查有关公式在计算中的应用,题目难度中等,注意把握溶度积常数的含义和平衡常数的含义.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
价电子满足4s和3d为半满的元素是( )
| A、Ca | B、V | C、Cr | D、Cu |
经测定某种溶液中只含NH4+、Cl-、H+、OH-四种离子,下列说法错误的是( )
| A、若满足:c(Cl-)=c(NH4+)>c(OH-)=c(H+),则溶质一定是NH4Cl |
| B、若满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+),则溶质一定是NH4Cl和NH3-?H2O |
| C、溶液中四种离子之间可能满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| D、若满足:c(NH4+)=c(Cl-),则溶液一定呈中性 |
下列关于淀粉、脂肪、蛋白质的说法中错误的是( )
| A、它们都是生活中常见的高分子化合物 |
| B、它们都是有机化合物 |
| C、它们在一定条件下都能发生水解反应 |
| D、它们都是生物体进行生命活动的能源 |
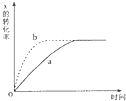 如图曲线a表示放热反应 X(g)+Y(g)?Z(g)+M(g)+N(s) 进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
如图曲线a表示放热反应 X(g)+Y(g)?Z(g)+M(g)+N(s) 进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )| A、缩小容器的容积 |
| B、升高温度 |
| C、加大X的投入量 |
| D、增大容器的体积 |
在恒温恒容体积相同的甲、乙密闭容器中,分别充入1molNH3和2molNH3,平衡时,甲、乙两容器中混合气体的平均相对分子质量分别为x和y,则x和y的大小关系为( )
| A、x>y | B、x<y |
| C、x=y | D、无法判断 |

 如图是目前世界上比较先进的电解饱和食盐水制碱技术--离子交换膜.分别写出①、④、⑤各表示什么物质:
如图是目前世界上比较先进的电解饱和食盐水制碱技术--离子交换膜.分别写出①、④、⑤各表示什么物质: 某学生利用下面实验装置探究盐桥式原电池的工作原理.
某学生利用下面实验装置探究盐桥式原电池的工作原理.