题目内容
下列化学用语书写正确的是( )
| A、SO2气体通入到溴水中:SO2+Br2+2H2O=4H++SO42-+2Br- |
| B、碳酸钡溶液醋酸:BaCO3+2H+=Ba2++H2O+CO2↑ |
| C、硫氢化钠水解:HS-+H2O=H3O++S2- |
| D、明矾溶液中加入过量的氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.反应生成硫酸和氢溴酸;
B.醋酸在离子反应中保留化学式;
C.水解生成氢硫酸和氢氧根离子;
D.反应生成氢氧化铝、硫酸铵、硫酸钾.
B.醋酸在离子反应中保留化学式;
C.水解生成氢硫酸和氢氧根离子;
D.反应生成氢氧化铝、硫酸铵、硫酸钾.
解答:
解:A.SO2气体通入到溴水中的离子反应为SO2+Br2+2H2O=4H++SO42-+2Br-,遵循电子、电荷守恒,故A正确;
B.碳酸钡溶液醋酸的离子反应为BaCO3+2HAc=Ba2++H2O+CO2↑+2Ac-,故B错误;
C.硫氢化钠水解的离子反应为HS-+H2O=H2S+OH-,故C错误;
D.明矾溶液中加入过量的氨水的离子反应为Al3++3NH3?H2O=Al(0H)3↓+3NH4+,故D错误;
故选A.
B.碳酸钡溶液醋酸的离子反应为BaCO3+2HAc=Ba2++H2O+CO2↑+2Ac-,故B错误;
C.硫氢化钠水解的离子反应为HS-+H2O=H2S+OH-,故C错误;
D.明矾溶液中加入过量的氨水的离子反应为Al3++3NH3?H2O=Al(0H)3↓+3NH4+,故D错误;
故选A.
点评:本题考查离子反应的书写,为高频考点,把握离子之间的反应及离子反应的书写方法为解答的关键,侧重复分解反应、水解、氧化还原反应的离子反应考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
下列关于稀有气体的叙述不正确的是( )
| A、各原子轨道电子均已填满 |
| B、其原子与同周期ⅠA、ⅡA族阳离子具有相同的核外电子排布 |
| C、化学性质非常不活泼 |
| D、同周期中第一电离能最大 |
下列微粒中不能破坏水的电离平衡的是( )
| A、Na HSO4 |
| B、Al3+ |
| C、CO32- |
| D、K+ |
 常温下,向一定体积的1mol.L-1的醋酸溶液中逐滴加入等浓度的氢氧化钠溶液,溶液中pOH和pH的变化如图所示,已知该条件下醋酸的电离程度为0.4%,则下列说法不正确的是( )
常温下,向一定体积的1mol.L-1的醋酸溶液中逐滴加入等浓度的氢氧化钠溶液,溶液中pOH和pH的变化如图所示,已知该条件下醋酸的电离程度为0.4%,则下列说法不正确的是( )| A、a为7 |
| B、Q点的水的电离程度在整条曲线中最大 |
| C、M和Q之间(不含Q)的溶液离子浓度排序都满足c(CH3COO-)>c(Na+) |
| D、三点所代表的溶液导电能力,N最大,M最小 |
下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A、0.1mol/L NaHCO3溶液中:c(H+)+c(Na+)=c(OH-)+c(HCO3-)+c(CO32-) |
| B、一定量(NH4)2SO4与NH3?H2O混合所得的酸性溶液中:c(NH4+)=2c(SO42-) |
| C、将0.2mol/L CH3COOH溶液和0.1mol/L NaOH溶液等体积混合,则反应后的混合液中:c(OH-)+c(CH3COO-)=c(H+)+c(Na+) |
| D、物质的量浓度相等的①NH4HSO4溶液、②NH4HCO3溶液、③NH4Cl溶液中,c(NH4+)的大小关系:①>②>③ |
下列性质不是由氢键引起的( )
| A、水的熔点比硫化氢高 |
| B、H-F的键能很大 |
| C、乙醇与水能以任意比例混溶 |
| D、冰的密度比水小 |
在2L的密闭容器中进行如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),有如下数据:
下列说法正确的是( )
| 实验 | 温度/℃ | 起始量/mol | 平衡量/mol | |||
| CO | H2O | CO2 | H2 | CO2 | ||
| 1 | 650 | 2.0 | 1.0 | 0 | 0 | 0.8 |
| 2 | 800 | 2.0 | 2.0 | 0 | 0 | 1.0 |
| A、正反应为吸热反应 | ||
| B、实验1中,CO的转化率为80% | ||
C、650℃时,化学平衡常数K=
| ||
| D、实验1再加入1.0 mol H2O,重新达到平衡时,n(CO2)为1.6 mol |
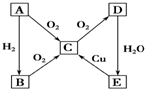 在通常状况下,A为固态单质.根据图转化关系,回答:
在通常状况下,A为固态单质.根据图转化关系,回答: