题目内容
3.下列的实验操作、现象与解释均正确的是( )| 编号 | 实验操作 | 实验现象 | 解释 |
| A | 将铜粉加入1.0mol/LFe(SO4)3溶液中 | 溶液变蓝 | 金属铁比铜活泼 |
| B | 将在Na2SiO3稀溶液中浸泡过的小木条立即置于酒精灯外焰 | 小木条不易燃烧 | Na2SiO3溶液有阻燃的作用 |
| C | 向NaBr溶液中滴加氯水 | 溶液颜色变成橙黄色 | 氯水中含有HClO |
| D | 将一小块金属钠放置于坩埚里加热 | 钠块先融化成小球,再燃烧 | 钠的熔点比钠的着火点低 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Cu与硫酸铁反应生成硫酸铜、硫酸亚铁;
B.硅酸钠液中浸泡过的小木条,干燥后检验;
C.氯气与NaBr反应生成溴;
D.钠燃烧生成过氧化钠,先熔化后燃烧.
解答 解:A.Cu与硫酸铁反应生成硫酸铜、硫酸亚铁,则溶液变蓝,解释不合理,故A错误;
B.硅酸钠液中浸泡过的小木条,干燥后检验,有水时小木条不易燃烧,故B错误;
C.氯气与NaBr反应生成溴,则不能说明氯水中含HClO,故C错误;
D.钠燃烧生成过氧化钠,先熔化后燃烧,则钠的熔点比钠的着火点低,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应与现象、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.下列物质中,既能与盐酸反应,又能与氢氧化钠溶液反应的是( )
①NaHSO4②Al2O3 ③NaHSO3 ④(NH4)2CO3.
①NaHSO4②Al2O3 ③NaHSO3 ④(NH4)2CO3.
| A. | ②③④ | B. | ①②③④ | C. | ②③ | D. | ①②③ |
11.除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的是( )
| A. | 硝基苯(硝酸) NaOH溶液 分液 | |
| B. | 乙烯(二氧化硫) 酸性高锰酸钾 洗气 | |
| C. | 乙酸乙酯(乙酸) NaOH溶液 蒸馏 | |
| D. | 苯(苯酚) 溴水 过滤 |
18.下列有关化学用语表达正确的是( )
| A. | NH4Cl 的电子式: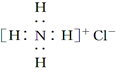 | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | 用电子式表示氧化钠的形成过程: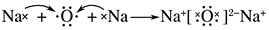 |
8.下列说法正确的是( )
| A. | 葡萄糖制镜利用了葡萄糖的氧化性 | |
| B. | 室温下,在水中的溶解度:乙醇>苯酚>乙酸乙酯 | |
| C. | 酯在碱性条件下水解生成对应的酸和醇 | |
| D. | 甲苯能使酸性高锰酸钾溶液褪色,说明甲基使苯环变活泼 |
15.表列出了元素周期表中6种短周期元素的有关数据.
根据表中信息回答下列问题(均使用化学用语填空):
(1)写出下列编号对应元素的符号:②P,③Li.
(2)表中元素的最高价氧化物对应的水化物中,酸性最强的物质与碱性最强的物质反应生成的盐的化学式为NaClO4.
(3)请写出①、②、④三种元素的简单氢化物的稳定性由强到弱的顺序HF>NH3>PH3.
(4)元素⑥所在的主族中,氢化物的还原性最强的是HI.
(放射性元素除外)
| 元素编号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 原子半径(nm) | 0.075 | 0.110 | 0.152 | 0.071 | 0.186 | 0.099 |
| 最高价态 | +5 | +5 | +1 | 0 | +1 | +7 |
| 最低价态 | -3 | -3 | 0 | -1 | 0 | -1 |
(1)写出下列编号对应元素的符号:②P,③Li.
(2)表中元素的最高价氧化物对应的水化物中,酸性最强的物质与碱性最强的物质反应生成的盐的化学式为NaClO4.
(3)请写出①、②、④三种元素的简单氢化物的稳定性由强到弱的顺序HF>NH3>PH3.
(4)元素⑥所在的主族中,氢化物的还原性最强的是HI.
(放射性元素除外)
12.化学与生产、生活密切相关,下列说法正确的是( )
| A. | 氢氟酸可蚀刻玻璃说明氢氟酸具有强酸性 | |
| B. | 油脂的氢化说明油脂分子中含有不饱和键 | |
| C. | 维生素C常用作抗氧化剂说明它具有氧化性 | |
| D. | 汽车尾气中含有氮氧化物说明汽油中含有氮元素 |
3.某学生化学课外兴趣小组欲探究CuSO4溶液与Na2CO3溶液混合产生的蓝绿色沉淀组成,进行了下列实验探究.
【提出假设】
假设1:沉淀为CuCO3;
假设2:沉淀为Cu(OH)2;
假设3:沉淀为碱式碳酸铜[化学式可表示为nCu(OH)2•mCuCO3].
【查阅资料】这三种沉淀受热均易分解,都生成黑色固体CuO.
【实验探究】
步骤1:将所得悬浊液过滤,先用蒸馏水洗涤,再用无水乙醇洗涤,风干;
步骤2:取一定量所得固体,用如图装置(夹持仪器未画)进行定性实验;
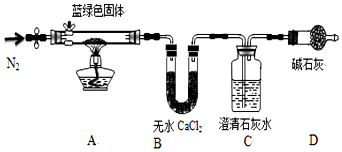
【问题讨论】
(1)假设2中的沉淀为Cu(OH)2,提出该假设的理论依据是碳酸根水解,溶液中含有较多的OH-
(2)步骤1用无水乙醇洗涤,再风干的目的利用乙醇的易挥发,带走洗涤的水;
(3)装置D装有碱石灰的干燥管所起的作用是利用乙醇的易挥发,带走洗涤的水
(4)若反应后A中蓝绿色固体变黑,C中澄清石灰水变浑浊,证明假设假设2(填写序号)一定不成立
(5)乙同学认为只要将图中B装置的试剂改用下列某试剂后,通过观察便可验证上述所有假设,该试剂是b(填代号)
a.浓硫酸 b.无水CuSO4 c.碱石灰 d.P2O5
(6)该小组经试验确定假设3成立,他们想进一步测定蓝绿色固体的化学式,丙同学查得一些物质在20℃的数据(如下表)后,建议将C中的澄清石灰水改为Ba(OH)2溶液,其原因是ac(双选,填代号)
a.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
b.Ba(OH)2为强碱,Ca(OH)2为弱碱
c.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
d.相同条件下,CaCO3的溶解度明显大于BaCO3
(7)作上述调整后,若所取蓝绿色固体质量为27.1g,实验结束后装置B中无水氯化钙的质量增加2.7g,C中氢氧化钡溶液里产生沉淀的质量为19.7g.则该蓝绿色固体的化学式为2CuCO3•3Cu(OH)2或3Cu(OH)2•2CuCO3或Cu5(OH)6(CO3)2.
【提出假设】
假设1:沉淀为CuCO3;
假设2:沉淀为Cu(OH)2;
假设3:沉淀为碱式碳酸铜[化学式可表示为nCu(OH)2•mCuCO3].
【查阅资料】这三种沉淀受热均易分解,都生成黑色固体CuO.
【实验探究】
步骤1:将所得悬浊液过滤,先用蒸馏水洗涤,再用无水乙醇洗涤,风干;
步骤2:取一定量所得固体,用如图装置(夹持仪器未画)进行定性实验;

【问题讨论】
(1)假设2中的沉淀为Cu(OH)2,提出该假设的理论依据是碳酸根水解,溶液中含有较多的OH-
(2)步骤1用无水乙醇洗涤,再风干的目的利用乙醇的易挥发,带走洗涤的水;
(3)装置D装有碱石灰的干燥管所起的作用是利用乙醇的易挥发,带走洗涤的水
(4)若反应后A中蓝绿色固体变黑,C中澄清石灰水变浑浊,证明假设假设2(填写序号)一定不成立
(5)乙同学认为只要将图中B装置的试剂改用下列某试剂后,通过观察便可验证上述所有假设,该试剂是b(填代号)
a.浓硫酸 b.无水CuSO4 c.碱石灰 d.P2O5
(6)该小组经试验确定假设3成立,他们想进一步测定蓝绿色固体的化学式,丙同学查得一些物质在20℃的数据(如下表)后,建议将C中的澄清石灰水改为Ba(OH)2溶液,其原因是ac(双选,填代号)
| 溶解度(s)/g | 溶度积(Ksp) | 摩尔质量(M)g/mol | |||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 | 100 | 197 |
b.Ba(OH)2为强碱,Ca(OH)2为弱碱
c.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
d.相同条件下,CaCO3的溶解度明显大于BaCO3
(7)作上述调整后,若所取蓝绿色固体质量为27.1g,实验结束后装置B中无水氯化钙的质量增加2.7g,C中氢氧化钡溶液里产生沉淀的质量为19.7g.则该蓝绿色固体的化学式为2CuCO3•3Cu(OH)2或3Cu(OH)2•2CuCO3或Cu5(OH)6(CO3)2.
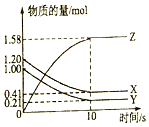 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示: