题目内容
11.除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的是( )| A. | 硝基苯(硝酸) NaOH溶液 分液 | |
| B. | 乙烯(二氧化硫) 酸性高锰酸钾 洗气 | |
| C. | 乙酸乙酯(乙酸) NaOH溶液 蒸馏 | |
| D. | 苯(苯酚) 溴水 过滤 |
分析 A.硝酸与NaOH反应后,与硝基苯分层;
B.二者均被高锰酸钾氧化;
C.二者均与NaOH反应;
D.溴、三溴苯酚均易溶于苯.
解答 解:A.硝酸与NaOH反应后,与硝基苯分层,然后分液可分离,故A正确;
B.二者均被高锰酸钾氧化,不能除去杂质,应选NaOH溶液、洗气,故B错误;
C.二者均与NaOH反应,应选饱和碳酸钠溶液、分液,故C错误;
D.溴、三溴苯酚均易溶于苯,引入新杂质,应选NaOH溶液、分液,故D错误;
故选A.
点评 本题考查混合物分离提纯,为高频考点,把握有机物的性质、混合物分离提纯方法为解答的关键,侧重分析与应用能力的考查,注意有机物性质的应用,题目难度不大.

练习册系列答案
相关题目
19.下列关于卤素的叙述,正确的是( )
| A. | 随核电荷数的增加 X-的半径递增,还原性递减(用X表示卤素原子) | |
| B. | 氢化物的稳定性随核电荷数的增加逐渐增强 | |
| C. | 单质与水反应均可表示为 X2+H2O═HX+HXO(用X表示卤素原子) | |
| D. | 单质的颜色随核电荷数的增加逐渐加深 |
6.I.一定量的CO(g)和H2O(g)分别通入容积为1L的恒容密闭容器中,发生反应CO(g)+H2O?CO2(g)+H2(g)得到如下三组数据:
(1)下列情况表明反应达到平衡状态的是C (填序号)
A.CO2和H2生成速率相等
B.温度不变时,压强不变
C.生成CO2的速率和生成CO的速率相等
(2)实验2中,反应达到平衡状态时,CO的转化率为20%.
(3)实验3和实验2相比,改变的条件是加催化剂.
II.(1)硫化钠溶液具有较强碱性,其原因是S2-+H2O?HS-+OH-,HS-+H2O?H2S+OH-(用离子方程式表示).
(2)欲使0.1mol的Na2S溶液中,$\frac{c(H{S}^{-})}{c({S}^{2-})}$的值增大,可采取的措施是BC(填序号)
A.加适量等浓度的NaOH溶液
B.加适量的水
C.通入适量的H2S气体.
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衝所需时间/min | ||
| CO | H2O | CO2 | ||||
| 1 | 500 | 8 | 4 | 3.2 | 4 | |
| 2 | 700 | 4 | 2 | 0.8 | 3 | |
| 3 | 700 | 4 | 2 | 0.8 | 1 | |
A.CO2和H2生成速率相等
B.温度不变时,压强不变
C.生成CO2的速率和生成CO的速率相等
(2)实验2中,反应达到平衡状态时,CO的转化率为20%.
(3)实验3和实验2相比,改变的条件是加催化剂.
II.(1)硫化钠溶液具有较强碱性,其原因是S2-+H2O?HS-+OH-,HS-+H2O?H2S+OH-(用离子方程式表示).
(2)欲使0.1mol的Na2S溶液中,$\frac{c(H{S}^{-})}{c({S}^{2-})}$的值增大,可采取的措施是BC(填序号)
A.加适量等浓度的NaOH溶液
B.加适量的水
C.通入适量的H2S气体.
16.下列反应的离子方程式及对应的说法都正确的是( )
| A. | 碳酸氢钙溶液加到醋酸溶液中:Ca(HCO3)2+2CH3COOH═Ca2++2CH3COO-+2CO2↑+2H2O | |
| B. | 漂白粉溶液中通入过量的CO2:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO3 | |
| C. | Fe-Cu-H2SO4溶液组成的原电池中负极反应式为:Fe-3e-=Fe3+ | |
| D. | 在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
3.下列的实验操作、现象与解释均正确的是( )
| 编号 | 实验操作 | 实验现象 | 解释 |
| A | 将铜粉加入1.0mol/LFe(SO4)3溶液中 | 溶液变蓝 | 金属铁比铜活泼 |
| B | 将在Na2SiO3稀溶液中浸泡过的小木条立即置于酒精灯外焰 | 小木条不易燃烧 | Na2SiO3溶液有阻燃的作用 |
| C | 向NaBr溶液中滴加氯水 | 溶液颜色变成橙黄色 | 氯水中含有HClO |
| D | 将一小块金属钠放置于坩埚里加热 | 钠块先融化成小球,再燃烧 | 钠的熔点比钠的着火点低 |
| A. | A | B. | B | C. | C | D. | D |
20.下列实验操作可以达到目的是( )
| 目的 | 操作 | |
| A | 提纯含有少量乙酸的乙酸乙酯 | 向含有少量乙酸的乙酸乙酯中加入过量饱和碳酸钠溶液,振荡后静置分液,并除去有机相的水 |
| B | 检验溴乙烷中的溴元素 | 取样,加NaOH溶液,振荡后再加AgNO3溶液 |
| C | 提纯含有少量苯酚的苯 | 向含有少量苯酚的苯中加入过量的浓溴水振荡后静置过滤,除去三溴苯酚沉淀 |
| D | 检验蔗糖是否水解 | 蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,观察现象 |
| A. | A | B. | B | C. | C | D. | D |
1.用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象和结论合理的是( )
| 选项 | ①中物质 | ②中的物质 | 预测②中的现象和结论 | 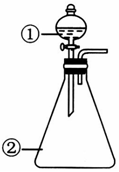 |
| A | 浓盐酸 | 二氧化锰 | 立即产生大量黄绿色气体,证明 HC1具有还原性和酸性 | |
| B | 草酸溶液 | 酸性高锰酸钾溶液 | 溶液逐渐褪色,证明草酸具有还原性 | |
| C | 硫酸铝饱和溶液 | 碳酸钠饱和溶液 | 立即产生大量气泡,证明两者相互促进水解 | |
| D | 蒸馏水 | 过氧化钠粉末 | 立即产生大量气泡,滴加酚酞溶液后变红,说明过氧化钠是碱性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
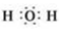 .
. (1)氮是地球上含量丰富的一种元素,氮及其化合物在工、农业生产和生活中有着重要作用.
(1)氮是地球上含量丰富的一种元素,氮及其化合物在工、农业生产和生活中有着重要作用.