题目内容
18.下列有关化学用语表达正确的是( )| A. | NH4Cl 的电子式: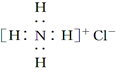 | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | 用电子式表示氧化钠的形成过程: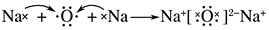 |
分析 A、氯化铵是由氨根离子与氯离子通过离子键结合而成的离子化合物;
B、次氯酸中O原子分别与H原子和Cl原子形成共价键;
C、乙烯的结构简式中碳碳双键不能省略;
D、氧化钠由2个钠原子和1个氧原子通过电子的得失形成.
解答 解:A、氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: ,故A错误;
,故A错误;
B、次氯酸中O原子分别与H原子和Cl原子形成共价键,故次氯酸的结构式为H-O-Cl,故B错误;
C、乙烯的结构简式中碳碳双键不能省略,故乙烯的结构简式为CH2=CH2,故C错误;
D、氧化钠由2个钠原子和1个氧原子通过电子的得失形成,其中钠原子失去电子,氧原子得到电子,故氧化钠的形成过程为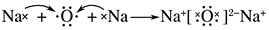 ,故D正确.
,故D正确.
故选D.
点评 本题考查电子式以及用电子式表示形成过程,为高频考点,侧重于学生的化学用语的考查,注意相关知识的学习,把握书写方法,难度不大.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
8.下列物质既能与盐酸反应又能与NaOH溶液反应,并且都放出氢气的是( )
| A. | Fe | B. | Al | C. | Al2O3 | D. | Si |
6.I.一定量的CO(g)和H2O(g)分别通入容积为1L的恒容密闭容器中,发生反应CO(g)+H2O?CO2(g)+H2(g)得到如下三组数据:
(1)下列情况表明反应达到平衡状态的是C (填序号)
A.CO2和H2生成速率相等
B.温度不变时,压强不变
C.生成CO2的速率和生成CO的速率相等
(2)实验2中,反应达到平衡状态时,CO的转化率为20%.
(3)实验3和实验2相比,改变的条件是加催化剂.
II.(1)硫化钠溶液具有较强碱性,其原因是S2-+H2O?HS-+OH-,HS-+H2O?H2S+OH-(用离子方程式表示).
(2)欲使0.1mol的Na2S溶液中,$\frac{c(H{S}^{-})}{c({S}^{2-})}$的值增大,可采取的措施是BC(填序号)
A.加适量等浓度的NaOH溶液
B.加适量的水
C.通入适量的H2S气体.
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衝所需时间/min | ||
| CO | H2O | CO2 | ||||
| 1 | 500 | 8 | 4 | 3.2 | 4 | |
| 2 | 700 | 4 | 2 | 0.8 | 3 | |
| 3 | 700 | 4 | 2 | 0.8 | 1 | |
A.CO2和H2生成速率相等
B.温度不变时,压强不变
C.生成CO2的速率和生成CO的速率相等
(2)实验2中,反应达到平衡状态时,CO的转化率为20%.
(3)实验3和实验2相比,改变的条件是加催化剂.
II.(1)硫化钠溶液具有较强碱性,其原因是S2-+H2O?HS-+OH-,HS-+H2O?H2S+OH-(用离子方程式表示).
(2)欲使0.1mol的Na2S溶液中,$\frac{c(H{S}^{-})}{c({S}^{2-})}$的值增大,可采取的措施是BC(填序号)
A.加适量等浓度的NaOH溶液
B.加适量的水
C.通入适量的H2S气体.
13.化学与社会、生产、生活、环境等密切相关,下列说法不正确的是( )
| A. | 东晋葛洪《肘后备急方》中记载了“青蒿一握,以水二升渍,绞取汁,…”,此过程属于物理变化 | |
| B. | 日本福岛核电站事故中,核原料裂变产生的2种放射性同位素碘-131和铯-137的中子数不同 | |
| C. | 乙烯与氧气在银催化作用下生成环氧乙烷符合绿色化学的原子经济性要求 | |
| D. | PM2.5是指天气中直径接近2.5×10-6m的颗粒物,其分散在空气中形成胶体 |
3.下列的实验操作、现象与解释均正确的是( )
| 编号 | 实验操作 | 实验现象 | 解释 |
| A | 将铜粉加入1.0mol/LFe(SO4)3溶液中 | 溶液变蓝 | 金属铁比铜活泼 |
| B | 将在Na2SiO3稀溶液中浸泡过的小木条立即置于酒精灯外焰 | 小木条不易燃烧 | Na2SiO3溶液有阻燃的作用 |
| C | 向NaBr溶液中滴加氯水 | 溶液颜色变成橙黄色 | 氯水中含有HClO |
| D | 将一小块金属钠放置于坩埚里加热 | 钠块先融化成小球,再燃烧 | 钠的熔点比钠的着火点低 |
| A. | A | B. | B | C. | C | D. | D |
10.下列反应中生成物总能量高于反应物总能量的是( )
| A. | 碳酸钙受热分解 | B. | 乙醇燃烧 | C. | 钠与水的反应 | D. | 铝热反应 |
7.下列关于原子结构、元素性质的说法正确的是( )
| A. | 非金属元素组成的化合物中只含共价键 | |
| B. | ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强 | |
| C. | 同种元素的原子均有相同的质子数和中子数 | |
| D. | IA族金属元素是同周期中金属性最强的元素 |
8.下列叙述正确的是( )
| A. | FeCl2有氧化性,能用于雕刻电路板 | |
| B. | 金刚石是自然界中硬度最大的物质,不与氧气发生反应 | |
| C. | 明矾加入水中能形成Al(OH)3胶体,可用作净水剂 | |
| D. | SiO2不与强酸反应,可用石英器皿盛装氢氟酸 |
 .
.