题目内容
某铝土矿的主要成分为Al2O3?xH2O,还含有Fe2O3和SiO2杂质.称取17.5g铝土矿样品,加入200mL1.65mol/L稀H2SO4,恰好完全反应,过滤得到滤渣0.3g,然后在滤液中加入足量NaOH溶液,得到沉淀2.14g.(提示:SiO2杂不与稀硫酸反应)
(1)写出本题涉及到的任意两个反应的化学方程式或离子方程式.
(2)该样品中,Fe2O3的物质的量.
(3)铝土矿样品中Al2O3的质量.
(4)试计算样品中Al2O3?xH2O的x值.(要求计算过程)
(1)写出本题涉及到的任意两个反应的化学方程式或离子方程式.
(2)该样品中,Fe2O3的物质的量.
(3)铝土矿样品中Al2O3的质量.
(4)试计算样品中Al2O3?xH2O的x值.(要求计算过程)
考点:有关混合物反应的计算,镁、铝的重要化合物,铁的氧化物和氢氧化物
专题:计算题,几种重要的金属及其化合物
分析:氧化铝、氧化铁与硫酸反应,而二氧化硅不反应,故0.3g为二氧化硅的质量,滤液中加入足量的氢氧化钠,铝离子转化为偏铝酸盐,故得到沉淀2.14g为氢氧化铁的质量.
(1)涉及反应有:氧化铝与硫酸反应生成硫酸铝与水,氧化铁与硫酸反应生成硫酸铁与水,硫酸铁与氢氧化钠反应生成氢氧化铁与硫酸钠.硫酸铝与足量氢氧化钠反应生成偏铝酸钠、硫酸钠与水;
(2)根据Fe元素守恒计算氧化铁的物质的量;
(3)根据硫酸根守恒:3n[Al2(SO4)3]+3n[Fe2(SO4)3]=n(H2SO4),据此计算n[Al2(SO4)3],再根据Al元素守恒计算n(Al2O3),根据m=nM计算m(Al2O3);
(4)先计算水的质量,再计算水的物质的量,进而计算x的值.
(1)涉及反应有:氧化铝与硫酸反应生成硫酸铝与水,氧化铁与硫酸反应生成硫酸铁与水,硫酸铁与氢氧化钠反应生成氢氧化铁与硫酸钠.硫酸铝与足量氢氧化钠反应生成偏铝酸钠、硫酸钠与水;
(2)根据Fe元素守恒计算氧化铁的物质的量;
(3)根据硫酸根守恒:3n[Al2(SO4)3]+3n[Fe2(SO4)3]=n(H2SO4),据此计算n[Al2(SO4)3],再根据Al元素守恒计算n(Al2O3),根据m=nM计算m(Al2O3);
(4)先计算水的质量,再计算水的物质的量,进而计算x的值.
解答:
解:氧化铝、氧化铁与硫酸反应,而二氧化硅不反应,故0.3g为二氧化硅的质量,滤液中加入足量的氢氧化钠,铝离子转化为偏铝酸盐,故得到沉淀2.14g为氢氧化铁的质量.
(1)涉及反应有:氧化铝与硫酸反应生成硫酸铝与水,氧化铁与硫酸反应生成硫酸铁与水,硫酸铁与氢氧化钠反应生成氢氧化铁与硫酸钠.硫酸铝与足量氢氧化钠反应生成偏铝酸钠、硫酸钠与水,任意两个反应离子方程式为:Fe3++3OH-=Fe(OH)3↓,Al3++4OH-=AlO2-+2H2O,
答:任意两个离子方程式为:Fe3++3OH-=Fe(OH)3↓,Al3++4OH-=AlO2-+2H2O 等;
(2)根据Fe元素守恒,n(Fe2O3)=
n[Fe(OH)3]=
×
=0.01mol,
答:该样品中,Fe2O3的物质的量为0.01mol;
(3)根据硫酸根守恒:3n[Al2(SO4)3]+3n[Fe2(SO4)3]=n(H2SO4),即3n[Al2(SO4)3]+3×0.01mol=0.2L×1.65mol/L,则n[Al2(SO4)3]=0.1mol,根据Al元素守恒,n(Al2O3)=n[Al2(SO4)3]=0.1mol,故m(Al2O3)=0.1mol×102g/mol=10.2g,
答:铝土矿样品中Al2O3的质量为10.2g;
(4)样品中水的质量为17.5g-0.3g-10.2g-0.01mol×160g/mol=5.4g,物质的量为
=0.3mol,则0.1mol:0.3mol=1:x,故x=3,
答:样品中Al2O3.xH2O的x值为3.
(1)涉及反应有:氧化铝与硫酸反应生成硫酸铝与水,氧化铁与硫酸反应生成硫酸铁与水,硫酸铁与氢氧化钠反应生成氢氧化铁与硫酸钠.硫酸铝与足量氢氧化钠反应生成偏铝酸钠、硫酸钠与水,任意两个反应离子方程式为:Fe3++3OH-=Fe(OH)3↓,Al3++4OH-=AlO2-+2H2O,
答:任意两个离子方程式为:Fe3++3OH-=Fe(OH)3↓,Al3++4OH-=AlO2-+2H2O 等;
(2)根据Fe元素守恒,n(Fe2O3)=
| 1 |
| 2 |
| 1 |
| 2 |
| 2.14g |
| 107g/mol |
答:该样品中,Fe2O3的物质的量为0.01mol;
(3)根据硫酸根守恒:3n[Al2(SO4)3]+3n[Fe2(SO4)3]=n(H2SO4),即3n[Al2(SO4)3]+3×0.01mol=0.2L×1.65mol/L,则n[Al2(SO4)3]=0.1mol,根据Al元素守恒,n(Al2O3)=n[Al2(SO4)3]=0.1mol,故m(Al2O3)=0.1mol×102g/mol=10.2g,
答:铝土矿样品中Al2O3的质量为10.2g;
(4)样品中水的质量为17.5g-0.3g-10.2g-0.01mol×160g/mol=5.4g,物质的量为
| 5.4g |
| 18g/mol |
答:样品中Al2O3.xH2O的x值为3.
点评:本题考查混合物计算,难度不大,明确发生的反应即可解答,注意守恒思想的应用.

练习册系列答案
 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
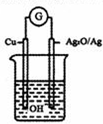 普通水泥在固化过程中自由水分子减少并形成碱性溶液,根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间.此法的原理,反应的总方程式为:2Cu+Ag2O═Cu2O+2Ag.下列有关说法正确的是( )
普通水泥在固化过程中自由水分子减少并形成碱性溶液,根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间.此法的原理,反应的总方程式为:2Cu+Ag2O═Cu2O+2Ag.下列有关说法正确的是( )| A、铜电极附近有黑色沉淀生成 |
| B、负极的电极反应式为2Cu+2OH--2e-═Cu2O+H2O |
| C、测量原理示意图中,电流方向从Cu经过导线流向Ag2O |
| D、电池工作时,溶液中OH-向正极移动 |
碱金属元素钠的电子层数是( )
| A、一层 | B、二层 | C、三层 | D、四层 |
1L0.1mol?L-1 AgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极增重2.16g时,下列判断正确的是(设电解按理论进行,溶液不蒸发)( )
| A、转移的电子数是1.204×1022 |
| B、阳极上产生112mLO2(标准状况) |
| C、溶液的浓度变化为0.08mol?L-1 |
| D、反应中有0.01molAg被氧化 |
50g镁、锌、铁的混合物与足量的稀硫酸反应得到混合溶液,蒸发得到218g固体(换算为无水硫酸盐).则反应产生氢气的质量是( )
| A、3.5g | B、3g |
| C、2g | D、4.5g |
 将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,向混合溶液中滴加1mol?L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断不正确的是( )
将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,向混合溶液中滴加1mol?L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断不正确的是( )| A、AB段发生反应的离子方程式为:Ba2++SO42-═BaSO4↓ |
| B、E点对应横坐标稀硫酸的体积为70 mL |
| C、D点表示的沉淀的化学式为Al(OH)3、BaSO4 |
| D、E点沉淀比A点沉淀质量大2.33g |
设NA为阿伏加德罗常数,下列说法中,正确的是( )
| A、2.7g金属铝所含电子数目为0.1 NA |
| B、16 g CH4所含原子数目为NA |
| C、17 g NH3 所含电子数目为NA |
| D、18 g水所含分子数目为NA |