题目内容
50g镁、锌、铁的混合物与足量的稀硫酸反应得到混合溶液,蒸发得到218g固体(换算为无水硫酸盐).则反应产生氢气的质量是( )
| A、3.5g | B、3g |
| C、2g | D、4.5g |
考点:有关混合物反应的计算
专题:计算题
分析:反应中Mg→MgSO4、Zn→ZnSO4、Fe→FeSO4,可知道固体增加的质量是硫酸根的质量,在H2SO4中氢元素与硫酸根的质量比为2:96,据此计算生成氢气的质量.
解答:
解:反应中Mg→MgSO4、Zn→ZnSO4、Fe→FeSO4,可知道固体增加的质量是硫酸根的质量,即硫酸根质量为218g-50g=168g,在H2SO4中氢元素与硫酸根的质量比为2:96,故生成氢气的质量为168g×
=3.5g,故选A.
| 2 |
| 96 |
点评:本题考查混合物计算,难度中等,侧重考查学生分析思维能力,注意根据质量守恒定律计算硫酸根的质量.

练习册系列答案
相关题目
下列关于氢化物的叙述中正确的是( )
| A、稳定性:H2S>HF |
| B、在卤化物中HF最稳定 |
| C、一个D2O分子所含的中子数为8 |
| D、HCl是离子化合物 |
下列关于电解饱和食盐水制取氯气的说法正确的是( )
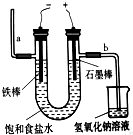

| A、通电一段时间后,与正极相连的电极周围的溶液能使酚酞变红 |
| B、与正极相连的电极上有氢气生成 |
| C、与负极相连的电极上有氯气生成 |
| D、为避免电解产物之间发生反应,常用石棉膜或离子交换膜将电解槽分隔成两部分 |
 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a﹙并滴有酚酞溶液﹚;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a﹙并滴有酚酞溶液﹚;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
 如图,p、q为直流电源的两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D极上均产生气泡.试回答:
如图,p、q为直流电源的两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D极上均产生气泡.试回答: 二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.
二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.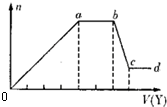 ①若Y是盐酸,则溶液中含有的金属阳离子是
①若Y是盐酸,则溶液中含有的金属阳离子是