题目内容
10.图装置中,“→”表示电子的移动方向,则电极材料A、B分别可能是( )
| A. | 石墨、石墨 | B. | Cu、Al | C. | Mg、石墨 | D. | Ag、Zn |
分析 根据电子的移动方向可知A是原电池的负极,B是正极,电解质是稀硫酸,则A是能与稀硫酸反应的活泼金属,即氢前的金属,B可以是氢后的金属或非金属,据此解答.
解答 解:A.石墨与稀硫酸不反应,不能形成原电池,故A错误;
B.Al比Cu活泼,所以Al作负极,与题意不符,故B错误;
C.Mg能与稀硫酸发生反应,镁作负极,失去的电子沿导线流向石墨,故C正确;
D.Zn比Ag活泼,Zn作负极,与题意不符,故D错误;
故选C.
点评 本题考查了原电池的工作原理,明确原电池的构成条件是解题关键,注意把握电子的运动方向,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列叙述中正确的是( )
| A. | 聚乙烯、植物油都是混合物,都能使溴的四氯化碳溶液褪色 | |
| B. | 苯、溴水、铁粉混合制成溴苯 | |
| C. | 沸点:戊烷>丁烷>乙烷 | |
| D. | 由丙烯加溴制1,2-二溴丙烷 |
1.如图所示为实验室制取少量乙酸乙酯的装置图.下列关于该实验的叙述错误的是( )
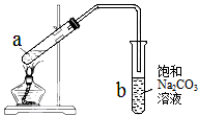

| A. | 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加入冰醋酸 | |
| B. | 试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象 | |
| C. | 实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使平衡向生成乙酸乙酯的方向移动 | |
| D. | 饱和Na2CO3溶液可以降低乙酸乙酯的溶解度,并吸收蒸出的乙酸和乙醇 |
5.用18O标记的CH3CH218OH与乙酸反应制取乙酸乙酯,下列说法正确的是( )
| A. | 18O 存在于水中 | |
| B. | 18O 存在于乙酸乙酯和乙醇中 | |
| C. | 18O 存在于乙酸乙酯和水中 | |
| D. | 生成的乙酸乙酯的相对分子质量为88 |
15.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 mol-CH3中含有的质子数为10NA | |
| B. | 25℃时,1 L pH=ll的氨水中OH-的数目为0.001NA | |
| C. | 1 mol苯乙烯(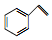 )中含有的碳碳双键数为4NA )中含有的碳碳双键数为4NA | |
| D. | 合成氨反应中投入28 g N2与足量H2,充分反应转移电子数为6 NA |
2.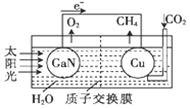 科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )
科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )
 科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )
科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )| A. | 电池工作时,是将太阳能转化为电能 | |
| B. | 铜电极为正极,电极反应式为:CO2+8e-+8H+═CH4+2H2O | |
| C. | 电池内部H+透过质子交换膜从左向右移动 | |
| D. | 为提高该人工光合系统的工作效率,可向装置中加入少量硝酸溶液 |
19.原子序数依次增大的X、Y、Z、W四种短周期元素,X、W原子的最外层电子数与其电子层数相等,X分别与Y、Z形成10电子的化合物P和Q.P能使湿润的红色石蕊试纸变蓝,Q常温下是一种液体.下列说法正确的是( )
| A. | 简单离子半径大小关系为W>Z | |
| B. | P形成的水溶液能导电,说明P属于电解质 | |
| C. | 电解W的氯化物水溶液可以得到W单质 | |
| D. | 由X、Y、Z组成的盐的水溶液呈酸性,则溶液中该盐阳离子浓度小于酸根离子浓度 |
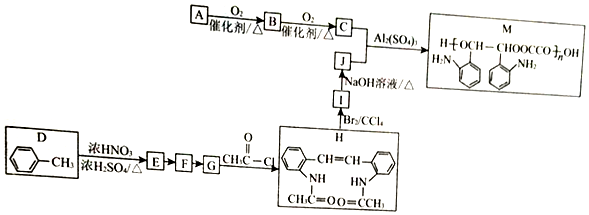
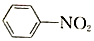 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$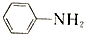 (-NH3容易被氧化)
(-NH3容易被氧化) $\stackrel{NaClO}{→}$
$\stackrel{NaClO}{→}$
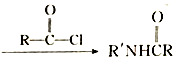 (R和R′代表烃基)
(R和R′代表烃基)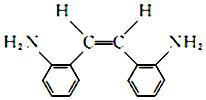 .
.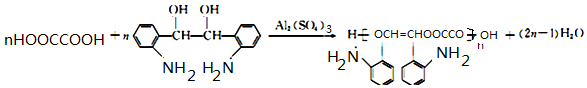 .
.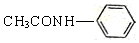 的合成路线
的合成路线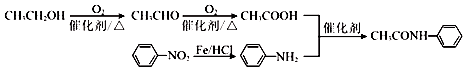 .
.
 ;
;