题目内容
设NA为阿伏加德罗常数,则下列说法正确的是( )
| A、1mol FeCl3形成的Fe(OH)3胶体中,胶体的颗粒为NA |
| B、标准状况下0.5mol NO和0.5mol O2组成的混合气体的体积约为22.4L |
| C、1mol Na2O2与水反应时转移电子数约为NA |
| D、含1mol HCl的浓盐酸与足量MnO2反应可制得0.25mol Cl2 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.氢氧化铁胶粒为氢氧化铁的聚集体,无法计算胶粒的数目;
B.一氧化氮与氧气反应生成二氧化氮,气体的物质的量减小;
C.过氧化钠中氧元素化合价为-1价,1mol过氧化钠与水完全反应生成0.5mol氧气,转移了1mol电子;
D.稀盐酸与二氧化锰不发生反应,生成的氯气的物质的量小于0.25mol.
B.一氧化氮与氧气反应生成二氧化氮,气体的物质的量减小;
C.过氧化钠中氧元素化合价为-1价,1mol过氧化钠与水完全反应生成0.5mol氧气,转移了1mol电子;
D.稀盐酸与二氧化锰不发生反应,生成的氯气的物质的量小于0.25mol.
解答:
解:A.由于氢氧化铁胶体为氢氧化铁的聚集体,无法计算氢氧化铁胶体中胶粒的物质的量及数目,故A错误;
B.0.5mol一氧化氮与0.25mol氧气反应生成0.25mol二氧化氮,导致气体的物质的量减小,反应后气体的体积小于22.4L,故B错误;
C.1mol过氧化钠与水反应生成0.5mol氧气,转移了1mol电子,转移电子数约为NA,故C正确;
D.1mol氯化氢完全转化成氯气,可以生成0.25mol氯气,由于浓盐酸变成稀盐酸后,反应停止,所以反应生成的氯气的物质的量小于0.25mol,故D错误;
故选C.
B.0.5mol一氧化氮与0.25mol氧气反应生成0.25mol二氧化氮,导致气体的物质的量减小,反应后气体的体积小于22.4L,故B错误;
C.1mol过氧化钠与水反应生成0.5mol氧气,转移了1mol电子,转移电子数约为NA,故C正确;
D.1mol氯化氢完全转化成氯气,可以生成0.25mol氯气,由于浓盐酸变成稀盐酸后,反应停止,所以反应生成的氯气的物质的量小于0.25mol,故D错误;
故选C.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确氢氧化铁胶粒为氢氧化铁的聚集体;掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项D为易错点,注意稀盐酸与二氧化锰不反应.

练习册系列答案
相关题目
某元素X的最高价氧化物的分子式为X2O5,则它的气态氢化物化学式为( )
| A、XH |
| B、H2X |
| C、XH3 |
| D、XH5 |
下列物质之间的转化不能通过一步化合反应实现的是( )
| A、Al2O3→Al(OH)3 |
| B、FeCl3→FeCl2 |
| C、Fe(OH)2→Fe(OH)3 |
| D、、Na2CO3→NaHCO3 |
利用如图装置,完成很多电化学实验.下列有关此装置的叙述中,正确的是( )
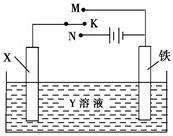

| A、若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阴极保护法 |
| B、若X为碳棒,Y为NaCl溶液,开关K置于N处,可加快铁的腐蚀 |
| C、若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动 |
| D、若X为铜棒,Y为硫酸铜溶液,开关K置于N处,可用于铁表面镀铜,溶液中铜离子浓度将减小 |
能用H++OH-═H2O表示的离子反应为( )
| A、氢氧化钡溶液和硫酸溶液 |
| B、氢氧化铜和硫酸溶液 |
| C、氢氧化钠溶液和盐酸溶液 |
| D、醋酸和氢氧化钠溶液 |
下列物质的燃烧产物,不会污染空气的是( )
| A、柴油 | B、氢气 | C、硫 | D、煤 |
NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、常温下,在18g18O2中含有NA个氧原子 |
| B、标准状况下,17g NH3所含共价键数为NA个 |
| C、标准状况下,22.4L苯的分子数约为NA个 |
| D、1mol Na2O2中含有的阴离子数目为2NA个 |
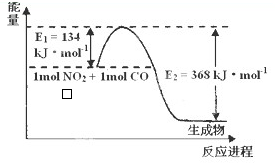 (1)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下:
(1)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下: