题目内容
 (1)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下:
(1)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下:aA(g)+bB (g)?2C(g)
起始物质的量(mol):3 2 0
2s末物质的量浓度(mol/L):0.9 0.8 0.4
则①a=
②2S内B的反应速率=
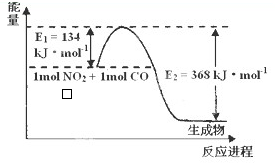
(2)1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式
考点:反应热和焓变,化学平衡建立的过程
专题:化学反应中的能量变化,化学平衡专题
分析:(1)依据化学平衡三段式列式计算;
aA(g)+bB (g)?2C(g)
起始物质的量(mol/L):1.5 1 0
变化量(mol/L) 0.6 0.2 0.4
2s末物质的量浓度(mol/L):0.9 0.8 0.4
①计算得到不合理是化学方程式的反应比,则a:b:c=0.6:0.2:0.4=3:1:2;
②反应速率V=
计算得到;
(2)依据图象分析计算反应的焓变=反应物断裂化学键吸收的能量-生成物化学键形成放出的能量,标注物质聚集状态和对应反应焓变写出反应的热化学方程式;
aA(g)+bB (g)?2C(g)
起始物质的量(mol/L):1.5 1 0
变化量(mol/L) 0.6 0.2 0.4
2s末物质的量浓度(mol/L):0.9 0.8 0.4
①计算得到不合理是化学方程式的反应比,则a:b:c=0.6:0.2:0.4=3:1:2;
②反应速率V=
| △c |
| △t |
(2)依据图象分析计算反应的焓变=反应物断裂化学键吸收的能量-生成物化学键形成放出的能量,标注物质聚集状态和对应反应焓变写出反应的热化学方程式;
解答:
解:(1)依据化学平衡三段式列式计算,单位换算为浓度;
aA(g)+bB (g)?2C(g)
起始物质的量(mol/L):1.5 1 0
变化量(mol/L) 0.6 0.2 0.4
2s末物质的量浓度(mol/L):0.9 0.8 0.4
①计算得到不合理是化学方程式的反应比,则a:b:c=0.6:0.2:0.4=3:1:2;则a=3,b=1;
故答案为:3,1;
②反应速率V=
计算得到,2S内B的反应速率=
=0.1mol/L?s;
故答案为:0.1mol/L?s;
(2)依据图象分析计算反应的焓变△H=反应物断裂化学键吸收的能量-生成物化学键形成放出的能量=134KJ/mol-368KJ/mol=-234KJ/mol,
热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1;
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1.
aA(g)+bB (g)?2C(g)
起始物质的量(mol/L):1.5 1 0
变化量(mol/L) 0.6 0.2 0.4
2s末物质的量浓度(mol/L):0.9 0.8 0.4
①计算得到不合理是化学方程式的反应比,则a:b:c=0.6:0.2:0.4=3:1:2;则a=3,b=1;
故答案为:3,1;
②反应速率V=
| △c |
| △t |
| 0.2mol/L |
| 2s |
故答案为:0.1mol/L?s;
(2)依据图象分析计算反应的焓变△H=反应物断裂化学键吸收的能量-生成物化学键形成放出的能量=134KJ/mol-368KJ/mol=-234KJ/mol,
热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1;
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1.
点评:本题考查了热化学方程式书写方法,化学平衡计算,反应速率概念计算应用,注意反应焓变和物质能量的计算关系,掌握基础是关键,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
设NA为阿伏加德罗常数,则下列说法正确的是( )
| A、1mol FeCl3形成的Fe(OH)3胶体中,胶体的颗粒为NA |
| B、标准状况下0.5mol NO和0.5mol O2组成的混合气体的体积约为22.4L |
| C、1mol Na2O2与水反应时转移电子数约为NA |
| D、含1mol HCl的浓盐酸与足量MnO2反应可制得0.25mol Cl2 |
生成乙酸乙酯的反应时可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态.下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有( )
| A、单位时间内生成1mol乙酸乙酯,同时生成1mol水 |
| B、单位时间内生成1mol乙酸乙酯,同时生成1mol乙酸 |
| C、单位时间内消耗1mol乙醇,同时消耗1mol乙酸 |
| D、正反应的速率与逆反应的速率相等 |



 下列化合物:①HCl ②NaOH ③CH3COOH ④NH3?H2O ⑤CH3COONa ⑥NH4Cl ⑦C2H5OH ⑧SO2
下列化合物:①HCl ②NaOH ③CH3COOH ④NH3?H2O ⑤CH3COONa ⑥NH4Cl ⑦C2H5OH ⑧SO2