题目内容
18. (1)已知1-丙醇和2-丙醇的结构简式如图:
(1)已知1-丙醇和2-丙醇的结构简式如图:1-丙醇:CH3-CH2-CH2-OH
2-丙醇:
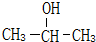
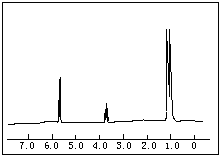
上图是这两种物质的其中一种的核磁共振谱,并且峰面积比分别为1:1:6,
请指出该核磁共振谱为何物质,并说明原因:2-丙醇;有三种峰,且峰面积比为1:1:6说明有三种不同化学环境的氢原子,且原子个数比为1:1:6,只有2-丙醇符合,而1-丙醇不符合
(2)CH3-C≡C-CH=CH2分子中有4个碳原子共线,5个碳原子共面,最少有8个原子共面,最多有9个原子共面.
分析 (1)核磁共振谱中的峰面积比分别为1:1:6,说明该有机物分子中含有的不同位置氢原子有3种,分别含有氢原子数之比为1:1:6;
(2)在常见的有机化合物中甲烷是正四面体结构,乙烯和苯是平面型结构,乙炔是直线型结构,其它有机物可在此基础上进行共线、共面分析判断.
解答 解:(1)根据该有机物的核磁共振谱中的峰面积比分别为1:1:6可知:该有机物分子中含有的不同位置氢原子有3种,分别含有氢原子数之比为1:1:6,1-丙醇(CH3-CH2-CH2-OH}中不同位置的氢原子有三种,其数目之比为1:3:4;
2-丙醇 中不同位置的氢原子有三种,其氢原子数目之比为1:1:6,
中不同位置的氢原子有三种,其氢原子数目之比为1:1:6,
所以满足条件的物质为:2-丙醇,
故答案为:2-丙醇;有三种峰,且峰面积比为1:1:6说明有三种不同化学环境的氢原子,且原子个数比为1:1:6,只有2-丙醇符合,而1-丙醇不符合;
(2)在CH3-C≡C-CH=CH2分子中,双键在同一平面内,三键在同一条直线上,故结构式为: ,甲基中C原子处于乙炔中H原子的位置,乙炔是直线型结构,有4个碳原子共线,乙烯是平面结构,所以最多有5个C原子共面;最多有9个原子(甲基中1个氢原子和一个碳原子、碳碳三键上2个碳、碳碳双键上2个C和3个氢原子)共面,最少有8个原子共面(甲基中一个碳原子、碳碳三键上2个碳、碳碳双键上2个C和3个氢原子);
,甲基中C原子处于乙炔中H原子的位置,乙炔是直线型结构,有4个碳原子共线,乙烯是平面结构,所以最多有5个C原子共面;最多有9个原子(甲基中1个氢原子和一个碳原子、碳碳三键上2个碳、碳碳双键上2个C和3个氢原子)共面,最少有8个原子共面(甲基中一个碳原子、碳碳三键上2个碳、碳碳双键上2个C和3个氢原子);
故答案为:4;5;8;9.
点评 本题考查有机物的结构,题目难度中等,注意掌握同分异构体中等效氢原子,注意从甲烷、乙烯、苯和乙炔的结构特点判断有机分子的空间结构,单键可以旋转.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.锌与100mL 18.5mol•L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲33.6L(标准状况).将反应后的溶液稀释至1L,测得c(H2SO4)=0.05mol/L,下列叙述不正确的是( )
| A. | 反应中共消耗1.8 mol H2SO4 | B. | 气体甲中SO2与H2的体积比为1:5 | ||
| C. | 反应中共消耗97.5 g Zn | D. | 反应中共转移3 mol电子 |
9.将下列物质加入水中,会显著放热的有( )
| A. | 烧碱 | B. | 浓硫酸 | C. | 食盐 | D. | 生石灰 |
6.微量元素硒(Se)对人体有保健作用,已知硒为第四周期第ⅥA族元素,根据它在周期表中的位置推测,下列对硒元素性质的描述不正确的是( )
| A. | 硒化氢不稳定 | |
| B. | 酸性强弱顺序:HClO4>H3AsO4>H2SeO4 | |
| C. | 硒与铁反应可生成FeSe | |
| D. | 最高氧化物的化学式是SeO3 |
13.0.02mol•L-1的HCN溶液与0.02mol•L-1 NaCN溶液等体积混合,已知混合溶液中pH>7,则下列关系中,正确的是( )
| A. | c(Na+)>c(CN-)>c(H+)>c(OH-) | B. | c(HCN)+c(CN-)=0.04 mol•L-1 | ||
| C. | c(Na+)+c(H+)=c(CN-)+c(OH-) | D. | c(CN-)>c(HCN) |
3.浓度均为0.1mol/L的下列溶液中:①盐酸 ②硫酸 ③氢氧化钠 ④醋酸,pH值由小到大的顺序( )
| A. | ①②④③ | B. | ③④②① | C. | ②①④③ | D. | ④②①③ |
10.25℃时将0.02mol/L Ba(OH)2溶液100mL和0.01mol/L H2SO4溶液100mL混合,若忽略溶液体积变化,则混合后的溶液( )
| A. | pH=13 | |
| B. | pH=2 | |
| C. | 由水电离出的c(H+)=0.01 mol/L | |
| D. | 溶质的物质的量浓度为0.005 mol/L |
8.如果一个反应△H-T△S值小于零,则此反应( )
| A. | 能自发进行 | B. | 是放热反应 | C. | 不能自发进行 | D. | 处于平衡状态 |