题目内容
10.25℃时将0.02mol/L Ba(OH)2溶液100mL和0.01mol/L H2SO4溶液100mL混合,若忽略溶液体积变化,则混合后的溶液( )| A. | pH=13 | |
| B. | pH=2 | |
| C. | 由水电离出的c(H+)=0.01 mol/L | |
| D. | 溶质的物质的量浓度为0.005 mol/L |
分析 100mL 0.02mol•L-1的Ba(OH)2溶液中氢氧根离子浓度物质的量为:0.02mol•L-1×0.1L×2=0.004mol;100mL 0.01mol•L-1的H2SO4溶液中氢离子的物质的量为:0.01mol•L-1×2×0.1L=0.002mol,两溶液混合后氢氧根离子过量,溶液显示碱性,根据氢氧根离子、氢离子的物质的量计算出混合后溶液中氢氧根离子的浓度,再计算出溶液的pH;碱性溶液中的氢离子是水的电离,据此计算出水电离的氢离子浓度;氢氧化钡与硫酸按照2:1反应,反应后氢氧化钡过量,根据c=$\frac{n}{V}$计算出混合液中氢氧化钡的浓度.
解答 解:100mL 0.02mol•L-1的Ba(OH)2溶液中氢氧根离子浓度物质的量为:0.02mol•L-1×0.1L×2=0.004mol;100mL 0.01mol•L-1的H2SO4溶液中氢离子的物质的量为:0.01mol•L-1×2×0.1L=0.002mol,
A.两溶液混合后,氢氧根离子过量,溶液显示碱性,反应后的溶液中氢氧根离子浓度为:$\frac{0.004mol-0.002mol}{0.1L+0.1L}$=0.01mol/L,溶液的pH=12,故A错误;
B.根据A的计算结果可知,反应后的溶液的pH=12,故B错误;
C.碱溶液中氢离子是水电离的,水电离的氢离子浓度为为1.0×10-12 mol•L-1,故C错误;
D.反应后氢氧化钡过量,则混合液中氢氧化钡的浓度为:$\frac{0.02mol/L×0.1L-0.01mol×0.1L}{0.1L+0.1L}$=0.005mol/L,故D正确;
故选D.
点评 本题考查了酸碱混合后的定性判断及溶液的pH的计算,题目难度中等,注意掌握酸碱反应后溶液定性判断方法及溶液的pH的计算方法,选项D混合后溶液的体积增大了一倍,生成的氢氧化钠的浓度减小一半,为易错点.

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案①放电时,Fe为正极,Ni2O3为负极;
②充电时,阴极上的电极反应式是:Fe(OH)2+2e-═Fe+2OH-;
③充电时,Ni(OH)2为阳极;
④蓄电池的电极必须浸在某碱性溶液中.
| A. | ①②③ | B. | ②③ | C. | ①③④ | D. | ②③④ |
| A. | OH- Mg2+ NH4+Cl- | B. | Cl- K+ Na+ Ba2+ | ||
| C. | Ba2+Cl-Cu2+ NO3- | D. | H+ Na+ CO32-Cl- |
| A. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ/mol,则40gNaOH固体与稀盐酸完全中和,放出的热量即为57.3 kJ | |
| B. | 已知C(s)+O2(g)=CO2(g)△H1;C(s)+$\frac{1}{2}$O2(g)=CO (g)△H2,则△H1<△H2 | |
| C. | 已知H2(s)+Cl2(g)=2HCl (g)△H=-184.6 kJ/mol,则反应物总能量小于生成物总能量 | |
| D. | 已知P(白磷,s)=P(红磷,s)△H<0,则白磷比红磷稳定 |
| A. | 溶液中一定存在CO32-、SO42-、Na+ | B. | 溶液中 c (Na+)≥0.6mol•L-1 | ||
| C. | 溶液中一定没有Ba2+,可能存在Cl- | D. | 溶液中n(SO42-)≤0.02 mol |
| A. | 镁与稀盐酸反应 | B. | CO燃烧生成CO2 | ||
| C. | 氢氧化钡晶体与氯化铵晶体反应 | D. | 生石灰溶于水 |
| A. | 一定温度下,10mL 0.50mol•L-1NH4Cl溶液与20mL 0.25mol•L-1NH4C1溶液含NH4+物质的量相同 | |
| B. | 25℃时,将a mo1•L-l氨水与0.01 moI•L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),用含a的代数式表示反应完全时NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ | |
| C. | 一定温度下,已知0.1 mol•L-1 的醋酸溶液中存在电离平衡:CH3COOH?CH3COO-+H+,加少量烧碱溶液可使溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$值增大 | |
| D. | 等体积、pH都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:HA>HB |
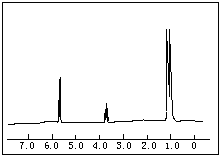 (1)已知1-丙醇和2-丙醇的结构简式如图:
(1)已知1-丙醇和2-丙醇的结构简式如图: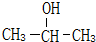
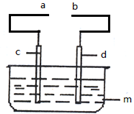 某小组为研究电化学原理,设计如图所示装置:
某小组为研究电化学原理,设计如图所示装置: