题目内容
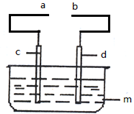
7.某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验.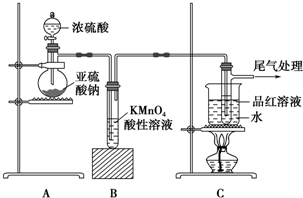
请回答下列问题.
(1)装置A中盛放亚硫酸钠的仪器名称是圆底烧瓶,其中发生反应的化学方程式为Na2SO3+H2SO4(浓)═Na2SO4+H2O+SO2↑.
(2)实验过程中,根据装置B中产生的现象,说明SO2具有还原性.
(3)尾气可采用NaOH溶液(填化学式)吸收.
分析 (1)依据仪器形状说出其名称,浓硫酸与亚硫酸钠反应生成二氧化硫和硫酸钠;
(2)二氧化硫具有强的还原性,能够还原酸性的高锰酸钾,使其褪色;
(3)二氧化硫有毒,需要进行尾气处理,二氧化硫为酸性氧化物能够与氢氧化钠溶液反应,被氢氧化钠吸收.
解答 解:(1)依据形状可知:装置A中盛放亚硫酸钠的仪器名称圆底烧瓶,反应方程式:Na2SO3+H2SO4(浓)═Na2SO4+H2O+SO2↑;
故答案为:Na2SO3+H2SO4(浓)═Na2SO4+H2O+SO2↑;
(2)二氧化硫具有强的还原性,能够还原酸性的高锰酸钾,使其褪色;
故答案为:还原性;
(3)二氧化硫为酸性氧化物能够与氢氧化钠溶液反应,被氢氧化钠吸收,化学式:NaOH;
故答案为:NaOH.
点评 本题考查了二氧化硫的实验室制备及性质检验,明确制备原理及二氧化硫性质是解题关键,题目难度不大.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
17.下列各组物质中,组成元素完全相同的是( )
| A. | 石墨与金刚石 | B. | 水银与银 | C. | 水晶与石灰石 | D. | 青铜与铜 |
2.今有一混合物水溶液,只可能含有以下离子中的若干种:Na+、Ba2+、Cl-、CO32-、SO42-,现取200mL 溶液加入BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g.根据上述实验,以下推断不正确的是( )
| A. | 溶液中一定存在CO32-、SO42-、Na+ | B. | 溶液中 c (Na+)≥0.6mol•L-1 | ||
| C. | 溶液中一定没有Ba2+,可能存在Cl- | D. | 溶液中n(SO42-)≤0.02 mol |
12.下列各组离子在指定条件下,一定能大量共存的是( )
| A. | pH=1的无色溶液:Na+、Cu2+、NO3-、SO42- | |
| B. | 能使碘化钾淀粉试纸变蓝的溶液:K+、Fe2+、SO42-、Cl- | |
| C. | 使酚酞变红的溶液:Ba2+、Na+、Cl-、NO3- | |
| D. | 能溶解Al(OH)3固体的溶液:K+、Na+、HCO3--、NO3-- |
19.下列变化中生成物的总能量大于反应物的总能量的是( )
| A. | 镁与稀盐酸反应 | B. | CO燃烧生成CO2 | ||
| C. | 氢氧化钡晶体与氯化铵晶体反应 | D. | 生石灰溶于水 |
16.以下物质间的每步转化通过一步反应能实现的是( )
| A. | Al→Al2O3→Al(OH)3→Na[Al(OH)4] | B. | N2→NO→NO2→HNO3 | ||
| C. | Si→SiO2→H2SiO3→Na2SiO3 | D. | S→SO3→H2SO4→MgSO4 |
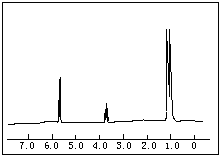 (1)已知1-丙醇和2-丙醇的结构简式如图:
(1)已知1-丙醇和2-丙醇的结构简式如图: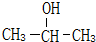
 某小组为研究电化学原理,设计如图所示装置:
某小组为研究电化学原理,设计如图所示装置: