题目内容
18.向含有AgI的饱和溶液中,分别进行如下操作:(1)加入固体AgNO3,则c(I-)减小
(2)若改加更多的AgI固体,则c(Ag+)不变
(3)若改加AgBr固体,则c(I-)减小.
分析 AgI的饱和溶液存在AgI(s)?Ag+(aq)+I-(Ag+),结合溶解平衡移动来解答.
解答 解:(1)加入固体AgNO3,c(Ag+)增大,溶解平衡逆向移动,则c(I-)减小,故答案为:减小;
(2)若改加更多的AgI固体,为AgI的溶解平衡溶液,不发生移动,则c(Ag+)不变,故答案为:不变;
(3)若改加AgBr固体,Ksp(AgBr)>Ksp(AgI),c(Ag+)增大,由Ksp不变可知,c(I-) 减小,故答案为:减小.
点评 本题考查溶解平衡移动,为高频考点,把握溶解平衡移动原理为解答的关键,侧重分析与应用能力的考查,注意(3)为解答的难点,题目难度不大.

练习册系列答案
相关题目
9.下列说法正确的是( )
| A. | 热化学方程式中,如没有注明温度和压强,表示反应热是在标准状况下测得的数据 | |
| B. | 物质发生化学变化不一定伴随着能量变化 | |
| C. | 发生碰撞的分子只要具有足够的能量,就能够发生有效碰撞 | |
| D. | 化学反应速率可通过实验测定,比如可以测量在一定温度和压强下释放出的气体的体积,或者可以用比色的方法测定溶液颜色的深浅进行换算 |
9.碳及其化合物在工业生产中有广泛的用途.回答下列问题:
(1)C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2的产率的是AD;(填序号)
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2)又知,C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1,则CO(g)+H2O(g)?CO2(g)+H2(g)的△H=-41.2kJ/mol;
(3)在一定温度下,将CO(g)和H2O(g)各0.16mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下数据:
①其他条件不变,降低温度,反应达到新平衡前v(逆)<v(正) (填“>”、“<”、“=”)
②该温度下此反应的平衡常数K=0.36;
③其他条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数不变(填“增大”、“减小”、“不变”).
(1)C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2的产率的是AD;(填序号)
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2)又知,C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1,则CO(g)+H2O(g)?CO2(g)+H2(g)的△H=-41.2kJ/mol;
(3)在一定温度下,将CO(g)和H2O(g)各0.16mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下数据:
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
②该温度下此反应的平衡常数K=0.36;
③其他条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数不变(填“增大”、“减小”、“不变”).
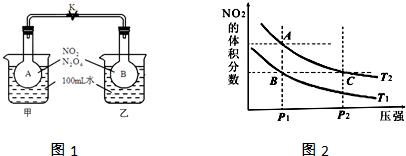
6.甲醇是重要的化工原料,又可作为燃料.工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下所示.
请回答下列问题:
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1•K2(用K1、K2表示).
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol•L-1)分别为0.8、0.1、0.3、0.15,则此时v正>v逆(填“>”、“=”或“<”).
(4)反应①按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图1所示.
下列说法正确的是C(填序号).
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c),v(b)>v(d)
C.平衡常数:K(a)>K(c),K(b)=K(d)
(5)新型高效的甲醇燃料电池采用铂为电极材料,两电极上分别通入CH3OH和O2.
某研究小组将两个甲醇燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图2所示.回答下列问题:
乙燃料电池的负极反应式为2CH3OH-12e-+16OH-=2CO32-+12H2O.
| 化学反应 | 平衡 常数 | 温度/℃ | ||
| 500 | 700 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.34 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 1.70 | 2.52 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | |||
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1•K2(用K1、K2表示).
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol•L-1)分别为0.8、0.1、0.3、0.15,则此时v正>v逆(填“>”、“=”或“<”).
(4)反应①按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图1所示.
下列说法正确的是C(填序号).
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c),v(b)>v(d)
C.平衡常数:K(a)>K(c),K(b)=K(d)
(5)新型高效的甲醇燃料电池采用铂为电极材料,两电极上分别通入CH3OH和O2.
某研究小组将两个甲醇燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图2所示.回答下列问题:

乙燃料电池的负极反应式为2CH3OH-12e-+16OH-=2CO32-+12H2O.
13.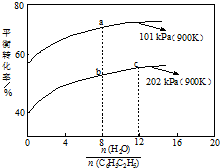 苯乙烯(C8H8)是生产各种塑料的重要单体,其制备原理是:
苯乙烯(C8H8)是生产各种塑料的重要单体,其制备原理是:
C8H10 (g)(乙苯)?C8H8 (g)(苯乙烯)+H2(g),
实际生产中常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),如图为乙苯的平衡转化率与水蒸气的用量、体系总压强的关系.下列说法正确的是( )
 苯乙烯(C8H8)是生产各种塑料的重要单体,其制备原理是:
苯乙烯(C8H8)是生产各种塑料的重要单体,其制备原理是:C8H10 (g)(乙苯)?C8H8 (g)(苯乙烯)+H2(g),
实际生产中常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),如图为乙苯的平衡转化率与水蒸气的用量、体系总压强的关系.下列说法正确的是( )
| A. | a点转化率为75%,若起始向1 L恒容容器中充入1 mol 乙苯,则平衡常数为2.25 | |
| B. | b点转化率为50%,则混合气体中苯乙烯的体积分数为$\frac{1}{19}$ | |
| C. | 恒容时加入稀释剂能减小C8H10 (g)平衡转化率 | |
| D. | b点和c点温度和压强相同,所以反应速率也相等 |
7.用红色激光照射下列物质,能观察到丁达尔效应的是( )
| A. | 乙醇溶液 | B. | 氢氧化铁胶体 | C. | 硫酸铜溶液 | D. | 蔗糖溶液 |