题目内容
17. 以NaCl等为原料制备KClO4的过程如下:
以NaCl等为原料制备KClO4的过程如下:①在无隔膜、微酸性条件下,发生反应:NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO3+H2↑(未配平)
②在NaClO3溶液中加入KCl发生复分解反应,降温结晶,得KClO3.
③一定条件下反应:4KClO3=3KClO4+KCl,将产物分离得到KClO4.
(1)电解时,产生质量为2.13g NaClO3,同时得到H2的体积为1.344L(标准状况).
(2)向NaClO3溶液中加入KCl能得到KClO3的原因是低温时,KClO3溶解度小,从溶液中结晶析出.
(3)该过程制得的KClO4样品中含少量KCl杂质,为测定产品纯度进行如下实验:
准确称取5.689g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使ClO4-全部转化为Cl-(反应为:3KClO4+C6H12O6═6H2O+6CO2↑+3KCl),加入少量K2CrO4溶液作指示剂,用0.20mol/L AgNO3溶液进行滴定至终点,消耗AgNO3溶液体积21.00mL.滴定达到终点时,产生砖红色Ag2CrO4沉淀.
①已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.1×10-12,若c(CrO42-)=1.1×10-4mol/L,
则此时c(Cl-)=1.8×10-6mol/L.
②计算KClO4样品的纯度(请写出计算过程.)n(AgNO3)=0.2000mol•L-1×0.021L=0.0042mol,
n(KCl)总=n(AgNO3)=0.0042mol
n(KClO4)+n(KCl)=0.0042mol,
n(KClO4)×138.5g•mol-1+n(KCl)×74.5g•mol-1=0.56890g,
n(KClO4)=0.0040mol,
m(KClO4)=0.004mol×138.5g•mol-1=0.554g,250ml溶液中m(KClO4)=5.54g
KClO4样品的纯度=$\frac{5.54g}{5.689g}$×100%=97.3%.
分析 (1)先配平化学方程式,结合化学方程式定量关系计算得到;
(2)在NaClO3溶液中加入KCl发生复分解反应,降温结晶,得KClO3.利用的是溶解度不同析出晶体;
(3)①依据Ksp(Ag2CrO4)=1.1×10-12,若c(CrO42-)=1.1×10-4mol/L,计算得到银离子浓度,结合Ksp(AgCl)=1.8×10-10,计算得到氯离子浓度;
②准确称取5.689g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使ClO4-全部转化为Cl-(反应为:3KClO4+C6H12O6═6H2O+6CO2↑+3KCl),加入少量K2CrO4溶液作指示剂,用0.20mol/L AgNO3溶液进行滴定至终点,消耗AgNO3溶液体积为21.00mL.
n(AgNO3)=0.2000 mol•L-1×0.021L=0.0042 mol,
n(KCl)总=n(AgNO3)=0.0042 mol
n(KClO4)+n(KCl)=0.0042 mol,
n(KClO4)×138.5 g•mol-1+n(KCl)×74.5 g•mol-1=0.56890g,
n(KClO4)=0.0040 mol,
m(KClO4)=0.004 mol×138.5 g•mol-1=0.554g,250ml溶液中m(KClO4)=5.54g,
纯度=$\frac{KCl{O}_{4}质量}{样品质量}$×100%.
解答 解:(1)电解时,产生质量为2.13g NaClO3,物质的量=$\frac{2.13g}{106.5g/mol}$=0.02mol
NaCl+3H2O=NaClO3+3H2↑,
1 3
0.02mol 0.06mol
同时得到H2的物质的量为0.06mol,体积=0.06mol×22.4L/mol=1.344L,
故答案为:1.344;
(2)在NaClO3溶液中加入KCl发生复分解反应,降温结晶,得KClO3的原因是低温时,KClO3溶解度小,从溶液中结晶析出,
故答案为:低温时,KClO3溶解度小,从溶液中结晶析出;
(3)①若c(CrO42-)=1.1×10-4mol/L,Ksp(Ag2CrO4)=c2(Ag+)c(CrO4 2-)=1.1×10-12,c(Ag+)=10-4mol/L,
Ksp(AgCl)=c(Ag+)c(Cl-)=1.8×10-10,c(Cl-)=1.8×10-6 mool/L,
故答案为:1.8×10-6;
②准确称取5.689g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使ClO4-全部转化为Cl-(反应为:3KClO4+C6H12O6═6H2O+6CO2↑+3KCl),加入少量K2CrO4溶液作指示剂,用0.20mol/L AgNO3溶液进行滴定至终点,消耗AgNO3溶液体积为21.00mL.
n(AgNO3)=0.2000 mol•L-1×0.021L=0.0042 mol,
n(KCl)总=n(AgNO3)=0.0042 mol
n(KClO4)+n(KCl)=0.0042 mol,
n(KClO4)×138.5 g•mol-1+n(KCl)×74.5 g•mol-1=0.56890g,
n(KClO4)=0.0040 mol,
m(KClO4)=0.004 mol×138.5 g•mol-1=0.554g,250ml溶液中m(KClO4)=5.54g
KClO4样品的纯度=$\frac{5.54g}{5.689g}$×100%=97.3%,
故答案为:97.3%.
点评 本题考查了物质的组成和含量的测定,主要是滴定实验的过程和计算,掌握基础是解题关键,题目难度中等.

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案| A. | 当X是盐酸时,则F是稀硝酸24 | |
| B. | 当X是氢氧化钠时,则F是稀硝酸y | |
| C. | 当X是氢氧化钠时,B跟Cl2反应可能有白烟现象e | |
| D. | 当X是氢氧化钠时,B能使酸性高锰酸钾溶液褪色N |
| A. | 热化学方程式中,如没有注明温度和压强,表示反应热是在标准状况下测得的数据 | |
| B. | 物质发生化学变化不一定伴随着能量变化 | |
| C. | 发生碰撞的分子只要具有足够的能量,就能够发生有效碰撞 | |
| D. | 化学反应速率可通过实验测定,比如可以测量在一定温度和压强下释放出的气体的体积,或者可以用比色的方法测定溶液颜色的深浅进行换算 |
 甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,
甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇.
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H
②CO(g)+2H2(g)?CH3OH(g)△H△
将0.20mol CH4和0.30mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如图:
(1)温度不变,缩小体积,①的逆反应速率增大(填“增大”、“减小”或“不变”).
(2)反应①的△H>0(填“<”“=”或“>”);
100℃时的平衡常数值K=1.35×10-3.
(3)在压强为0.1Mpa条件下,将a molCO与3a molH2的混合气体在催化剂作用下进行反应②
再生成甲醇.为了发寻找合成甲醇的适宜的温度和压强,某同学设计了二组实验,部分实验条件已经填在下面实验设计表中.请在空格中填入剩余的实验条件数据.
| 实验编号 | T(°C) | n(CO)/n(H2) | p(MPa) |
| Ⅰ | 150 | 1/3 | 0.1 |
| Ⅱ | 5 | ||
| Ⅲ | 350 | 5 |
字母)CD
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加D.重新平衡时c(H2)/c(CH2OH)减小
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△△H1=-1275.6kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△△H2=-556.0kJ•mol-1
③H2O(g)═H2O(l)△△H3=-44.0kJ•mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1.
(5)据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电.其电池
反应为:2CH3OH+3O2+4OH-?2CO32-+6H2O,放电时负极的电极反应方程为:CH3OH-6e-+8OH-=CO32-+6H2O.
(1)C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2的产率的是AD;(填序号)
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2)又知,C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1,则CO(g)+H2O(g)?CO2(g)+H2(g)的△H=-41.2kJ/mol;
(3)在一定温度下,将CO(g)和H2O(g)各0.16mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下数据:
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
②该温度下此反应的平衡常数K=0.36;
③其他条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数不变(填“增大”、“减小”、“不变”).
| 化学反应 | 平衡 常数 | 温度/℃ | ||
| 500 | 700 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.34 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 1.70 | 2.52 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | |||
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1•K2(用K1、K2表示).
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol•L-1)分别为0.8、0.1、0.3、0.15,则此时v正>v逆(填“>”、“=”或“<”).
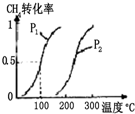
(4)反应①按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图1所示.
下列说法正确的是C(填序号).
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c),v(b)>v(d)
C.平衡常数:K(a)>K(c),K(b)=K(d)
(5)新型高效的甲醇燃料电池采用铂为电极材料,两电极上分别通入CH3OH和O2.
某研究小组将两个甲醇燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图2所示.回答下列问题:
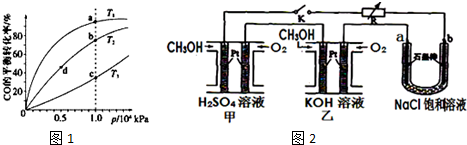
乙燃料电池的负极反应式为2CH3OH-12e-+16OH-=2CO32-+12H2O.
| A. | 乙醇溶液 | B. | 氢氧化铁胶体 | C. | 硫酸铜溶液 | D. | 蔗糖溶液 |
 .
.