题目内容
15.由Cu、N、B、Ni等元素组成的新型材料有着广泛用途.(1)基态 Cu+的最外层核外电子排布式为3s23p63d10.
(2)研究者预想合成一个纯粹由氮组成的新物种 N5+N3-,若N5+ 离子中每个氮原子均满足8电子结构,以下有关N5+ 推测正确的是C
A.N5+有24个电子
B. N5+离子中存在三对未成键的电子对
C. N5+阳离子中存在两个氮氮三键
(3)化合物 A(H3BNH3)3是一种潜在的储氢材料,它可由六元环状化合物 (HB=NH)3通过3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3 制得.
①与上述化学方程式有关的叙述不正确的是A.(填标号)
A.反应前后碳原子的轨道杂化类型不变
B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形
C.第一电离能:N>O>C>B
D.化合物A中存在配位键
②1个(HB=NH)3分子中有12个σ键.
(4)在硼酸盐中,阴离子有链状、环状等多种结构形式.图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为[BO2]nn-(或BO2-)图(b)是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为sp2、sp3.
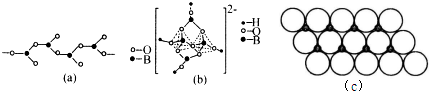
(5)NiO晶体结构与NaCl晶体类似,其晶胞的棱长为acm,则该晶体中距离最近的两个阳离子核间的距离为$\frac{\sqrt{2}}{2}$a(用含有a的代数式表示).在一定温度下,Ni0晶体可以自发地分散并形成“单分子层”(如图c),可以认为氧离子作密致单层排列,镍离子填充其中,列式并计算每平方米面积上分散的该晶体的质量为1.83×10-3g(氧离子的半径为1.40×10-10m,$\sqrt{3}$≈l.732).
分析 (1)Cu+基态核外电子排布式1s22s22p63s23p63d10;
(2)A.阳离子核外电子数=质子总数-电荷数;
B.N5+ 离子中每个氮原子均满足8电子且呈对称结构,N5+离子的结构为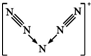 ,中间N原子有2对孤对电子;
,中间N原子有2对孤对电子;
C.根据B中结构式分析判断;
(3)①A.由方程式可知:碳元素由CH4变为CO2,碳原子杂化类型由sp3转化为sp;
B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形;
C.同周期随原子序数增大,第一电离能呈增大趋势,ⅡA族、ⅤA族元素第一电离能共有同周期相邻元素;
D.一般是形成3个键,(H3BNH3)由六元环状化合物(HB=NH)3通过3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3制得,其中1个键是配位键;
②1个(HB=NH)3分子中硼原子与氮原子间以σ键结合,而剩余的p轨道形成一个共轭大π键,B-H键有3个,N-H键有3个,B-N有σ键有6个;
(4)1个B原子连接3个O原子,其中2个氧原子分别为2个B原子共有,利用均摊法计算每个B原子连接O原子数目,进而确定多硼酸根离子符号;
硼砂晶体中存在形成2个σ键、3个σ键的B原子,B原子最外层电子数全部处于成键;
(5)根据氯化钠的结构知,氧离子和相邻的镍离子之间的距离为$\frac{1}{2}$a,距离最近的两个阳离子核间的距离是距离最近的氧离子和镍离子距离的$\sqrt{2}$倍;
根据图片知,每个氧化镍所占的面积=(2×1.40×10-10m)×(2×1.40×10-10m×sin60°),每个氧化镍的质量=$\frac{74.7}{{N}_{A}}$g,每个氧化镍的质量乘以每平方米含有的氧化镍个数就是每平方米含有的氧化镍质量.
解答 解:(1)Cu+基态核外电子排布式1s22s22p63s23p63d10,基态 Cu+的最外层电子排布式为:3s23p63d10,
故答案为:3s23p63d10;
(2)A.1个氮原子中含有7个电子,则1个N5分子中含有35个电子,N5+是由N5分子失去1个电子得到的,则1个N5+粒子中有34个电子,故A错误;
B.N5+ 离子中每个氮原子均满足8电子且呈对称结构,N5+离子的结构为 ,中间N原子有2对孤对电子,有4对未成键的电子对,故B错误;
,中间N原子有2对孤对电子,有4对未成键的电子对,故B错误;
C.N5+离子的结构为 ,则N5+阳离子中存在两个氮氮三键,故C正确.
,则N5+阳离子中存在两个氮氮三键,故C正确.
故选:C;
(3)①A.由方程式可知:碳元素由CH4变为CO2,碳原子杂化类型由sp3转化为sp,故A错误;
B.CH4分子中价层电子对=σ 键电子对+中心原子上的孤电子对=4+$\frac{1}{2}$×(4-4×1)=4,且不含孤电子对,所以其空间构型是正四面体,H2O中价层电子对个数=2+$\frac{1}{2}$×(6-2×1)=4,且含有2个孤电子对,所以H2O的VSEPR模型为四面体,分子空间构型为V型,、CO2分子中价层电子对=σ 键电子对+中心原子上的孤电子对=2+$\frac{1}{2}$×(4-2×2)=2,所以二氧化碳是直线型结构,故B正确;
C.同周期随原子序数增大,第一电离能呈增大趋势,ⅡA族、ⅤA族元素第一电离能共有同周期相邻元素,故所以它们的第一电离能大小顺序是I1(N)>I1(O)>I1(C)>I1(B),故C正确;
D.一般是形成3个键,(H3BNH3)由六元环状化合物(HB=NH)3通过3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3制得,其中1个键是配位键,故D正确,
故选:A;
②1个(HB=NH)3分子中硼原子与氮原子间以σ键结合,而剩余的p轨道形成一个共轭大π键,B-H键有3个,N-H键有3个,B-N有σ键有6个,故一共12个,
故答案为:12;
(4)1个B原子连接3个O原子,其中2个氧原子分别为2个B原子共有,则每个B原子实际结合O原子数目为1+2×$\frac{1}{2}$=2,代一个单位负电荷,故多硼酸根化学式为:[BO2]nn-(或BO2-),
硼砂晶体中存在形成2个σ键、3个σ键的B原子,B原子最外层电子数全部处于成键,故B原子采取sp2、sp3杂化,
故答案为:[BO2]nn-(或BO2-);sp2、sp3;
(5)根据氯化钠的结构知,氧离子和相邻的镍离子之间的距离为$\frac{1}{2}$a,距离最近的两个阳离子核间的距离是距离最近的氧离子和镍离子距离的$\sqrt{2}$倍,所以其距离是 $\frac{\sqrt{2}}{2}$acm;
根据图片知,每个氧化镍所占的面积=(2×1.40×10-10m)×(2×1.40×10-10m×sin60°)=4×1.40×10-10×1.40×10-10×sin60°m2,则每平方米含有的氧化镍个数=$\frac{1}{4×1.4×1{0}^{-10}×1.4×1{0}^{-10}×sin60°}$,每个氧化镍的质量=$\frac{74.7}{{N}_{A}}$g,所以每平方米含有的氧化镍质量=$\frac{74.7}{{N}_{A}}$g×$\frac{1}{4×1.4×1{0}^{-10}×1.4×1{0}^{-10}×sin60°}$=1.83×10-3,
故答案为:$\frac{\sqrt{2}}{2}$a;1.83×10-3.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、空间结构、化学键、杂化轨道、晶体结构与计算等,(5)中注意计算“1NiO”的体积应包含孔隙体积,难度较大.

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案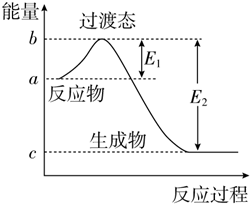 如图为1mol SO2Cl2(g)和1mol SCl2(g)反应生成SOCl2(g)过程中的能量变化示意图,已知E1=x kJ•mol-1、E2=y kJ•mol-1,下列有关说法中正确的是( )
如图为1mol SO2Cl2(g)和1mol SCl2(g)反应生成SOCl2(g)过程中的能量变化示意图,已知E1=x kJ•mol-1、E2=y kJ•mol-1,下列有关说法中正确的是( )| A. | 若在反应体系中加入催化剂,E1不变 | |
| B. | 若在反应体系中加入催化剂,△H减小 | |
| C. | 反应的活化能等于y kJ•mol-1 | |
| D. | 1 mol SO2Cl2(g)和1 mol SCl2(g)反应生成SOCl2(g)的△H=(x-y) kJ•mol-1 |
 (酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其中溶液的pH变化是判断滴定终点的依据.
(酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其中溶液的pH变化是判断滴定终点的依据.| 实验 序号 | 消耗0.1000mol•L-1的 盐酸溶液的体积/mL | 待测氢氧化钠 溶液的体积/mL |
| 1 | 29.02 | 25.00 |
| 2 | 28.01 | 25.00 |
| 3 | 27.99 | 25.00 |
(2)用0.1000mol•L-1的盐酸溶液滴定未知浓度的氢氧化钠溶液,重复三次的实验数据如表所示.则待测氢氧化钠的物质的量浓度是0.1120mol•L-1.在上述滴定过程中,若滴定前滴定管下端尖嘴中有气泡,滴定后气泡消失,则测定结果将偏高(填“偏高”、“偏低”或“不影响”).
(3)下列关于上述中和滴定过程中的操作正确的是AC(填序号)
A.用碱式滴定管量取未知浓度的烧碱溶液
B.滴定管和锥形瓶都必须用待盛放液润洗
C.滴定中始终注视锥形瓶中溶液颜色变化
D.锥形瓶中的待测液可用量筒量取.
 )是白色或淡黄色粉末,可通过如下实验步骤制得:
)是白色或淡黄色粉末,可通过如下实验步骤制得: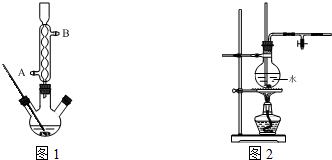
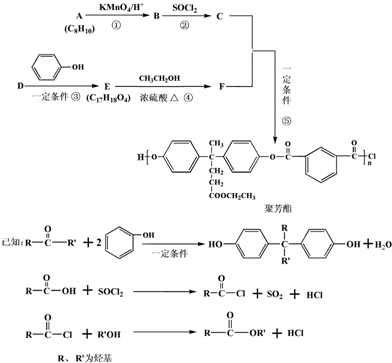
 .
. .
.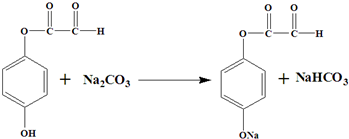 或
或 .
. 某学习小组以Mg(NO3)2为研究对象,拟通过实验初步探究硝酸盐热分解的规律.
某学习小组以Mg(NO3)2为研究对象,拟通过实验初步探究硝酸盐热分解的规律.